


| 0.00255mol |
| 3 |
| 0.00255mol |
| 3 |
| 0.3026g |
| 0.3107g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、11.2L氧气中所含有的原子数为NA |
| B、同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
| C、物质的量浓度为0.5mol?L-1的MgCl2溶液中,含有Cl-个数为NA |
| D、54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌片作负极,发生还原反应 |
| B、电流方向是由锌片流向铜片 |
| C、锌片质量逐渐减少,铜片上有气泡产生 |
| D、电解质溶液的氢离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 加入盐酸体积/mL | 剩余固体质量/g |
| 1 | 10 | 1.8 |
| 2 | 20 | 1.1 |
| 3 | 30 | 0.5 |
| 4 | 50 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
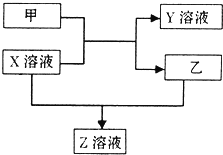 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com