
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA(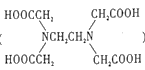 )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
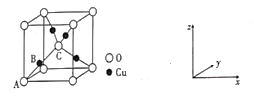
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
【答案】ⅠB 1s22s22p63s23p63d104s1 多 Cu+的价电子排布式为3d10,比Ni的稳定 sp2、sp3杂化 O、N、C V形 1∶1 (![]() ,
,![]() ,
,![]() )
) 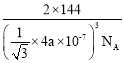
【解析】
(1)根据元素周期表,推出Cu位于周期表第四周期ⅠB族,其基态原子电子的排布式是1s22s22p63s23p63d104s1或[Ar] 3d104s1;
答案是ⅠB;1s22s22p63s23p63d104s1或[Ar] 3d104s1;
(2)①Ni和Cu相比,Ni的价电子排布式为3d84s2,Ni的基态原子有2个未成对电子,Cu的基态原子只有1个未成对电子,Ni基态原子中未成对电子多;
答案为多;
②Cu+的价电子排布式为3d10,处于全满,而Ni+的价电子排布式为3d84s1,因此Cu+第二电离能比Ni+的稳定;
答案是Cu+的价电子排布式为3d10,比Ni的稳定;
(3)EDTA中“-CH2”中C价层电子对数为4,即杂化类型为sp3,羧基中C的价层电子对数为3,即杂化类型为sp2;同周期从左向右电负性增强,即三种元素的电负性顺序是O>N>C;
答案是sp2、sp3杂化;O>N>C;
(4)①SO2中中心原子S有2个σ键,孤电子对数为![]() =1,即SO2的空间构型为V型;成键原子之间只能形成1个σ键,一般认为O2的结构式为O=O,其中含有一个个σ键和一个π键,即个数比为1:1;
=1,即SO2的空间构型为V型;成键原子之间只能形成1个σ键,一般认为O2的结构式为O=O,其中含有一个个σ键和一个π键,即个数比为1:1;
答案是V型;1:1;
②根据晶胞的结构,B点在A和C连线的中点,根据A和B的坐标,得出B原子的坐标为(![]() ,
,![]() ,
,![]() );根据晶胞的结构,Cu+全部位于晶胞内部,即Cu+个数为4,O2-位于顶点和内部,即O2-的个数为
);根据晶胞的结构,Cu+全部位于晶胞内部,即Cu+个数为4,O2-位于顶点和内部,即O2-的个数为![]() =2,化学式为Cu2O,该晶胞的质量为
=2,化学式为Cu2O,该晶胞的质量为![]() g,晶胞的边长为
g,晶胞的边长为![]() ,根据密度的定义,推出该晶胞的密度是
,根据密度的定义,推出该晶胞的密度是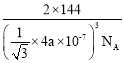 g/cm3;
g/cm3;
答案是(![]() ,
,![]() ,
,![]() );
);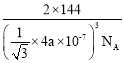 g/cm3。
g/cm3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4 溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是_______。
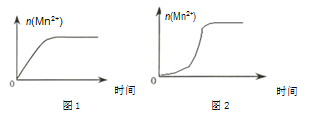
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是_______。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜 色褪至无色所需时间/min | |||
0.6mol/LH2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是_______。
③若该小组同学提出的假设成立,时间t_______4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
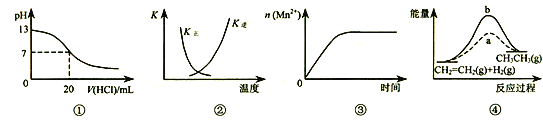
A. 图①表示25℃时,用0.1mol/L盐酸滴定20 mL0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0 正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol/L KMnO4 酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用,且是放热反应)
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
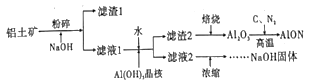
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____(写出一项即可)
(2)滤液1的溶质有NaOH、_____。滤渣2的成分是_____。向滤液1中加水的目的是_______。该过程也可用通入足量的_____气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____(填化学式)。整个流程中,可循环的物质是_____。
(4)写出制备AlON的化学方程式_______。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是( )
A. 第二阶段,Ni(CO)4分解率较高
B. 该反应达到平衡时,4v(Ni(CO)4)生成=v(CO)生成
C. 增加c(CO),平衡向正向移动,反应的平衡常数增大
D. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液在空气中缓慢变质为
溶液在空气中缓慢变质为![]() 中的一种或几种。已知:
中的一种或几种。已知:![]() ,
,![]() 是一种具有臭鸡蛋气味的气体。关于
是一种具有臭鸡蛋气味的气体。关于![]() 溶液变质情况的探究,下列说法不正确的是
溶液变质情况的探究,下列说法不正确的是
A. 向样品中加入足量稀盐酸,不变浑浊,再滴加![]() 溶液,产生白色沉淀,则样品中一定含有
溶液,产生白色沉淀,则样品中一定含有![]()
B. 向样品中加入足量稀盐酸,产生臭鸡蛋气味的气体,溶液变浑浊,则样品中至少含有![]() 、
、![]() ,中的一种
,中的一种
C. 向样品中加入足量稀盐酸,加热,产生使品红溶液褪色的气体,溶液变浑浊,则样品中至少含有![]() 中的一种
中的一种
D. 向样品中加入足量稀盐酸,加热,将产生的气体依次通过酸性高锰酸钾溶液、澄清石灰水,前者未完全褪色,后者变浑浊,则样品中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X是由两种短周期元素和一种长周期元素组成的盐,可溶于水,与酸反应只生成两种盐和水,某学习小组进行了如下实验:
①取![]() ,加入
,加入![]() 的盐酸,无气体产生,得澄清溶液,将其两等分;
的盐酸,无气体产生,得澄清溶液,将其两等分;
②向其中一份溶液中加入过量的![]() 溶液,过滤,得到溶液A和
溶液,过滤,得到溶液A和![]() 白色沉淀B,B是医疗上的胃肠造影剂;
白色沉淀B,B是医疗上的胃肠造影剂;
③向另一份溶液中逐滴加入![]() 的
的![]() 溶液,当
溶液,当![]() 时恰好中和,继续滴加生成白色沉淀,当
时恰好中和,继续滴加生成白色沉淀,当![]() 时,沉淀恰好溶解完全。
时,沉淀恰好溶解完全。
请回答:
(1)化合物X中三种元素对应的简单离子,半径最小的离子结构示意图为___________。
(2)化合物X的化学式为_______________。
(3)将化合物X完全溶于水后,溶液呈强碱性,通入足量![]() ,生成白色沉淀,写出通入足量
,生成白色沉淀,写出通入足量![]() 所发生反应的离子方程式:__________________。
所发生反应的离子方程式:__________________。
(4)设计实验检验溶液A中的阴离子(不考虑水的电离):_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜
B. 如图所示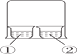 ,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成
,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成
C. AlCl3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
D. AlCl3溶液中滴加NaOH溶液后铝的存在形式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com