
【题目】草酸(H2C2O4)是最简单的有机二元酸,具有较强的还原性,工业上主要用于生产药物以及提炼稀有金属。
工业上可由以下反应制取草酸(两步反应均为液相反应):
①4CO+4C4H9OH+O2![]() 2(COOC4H9)2+2H2O
2(COOC4H9)2+2H2O
②(COOC4H9)2+2H2O![]() H2C2O4+2C4H9OH-Q(Q>0)
H2C2O4+2C4H9OH-Q(Q>0)
(1)反应①选择13~15MPa的高压条件下进行,最主要的原因是为了___。若5min内水的质量增加了7.2g/L,则用水表示的反应速率为____。
(2)对于反应②,下列能够说明其已经达到平衡的是____。
a.平衡常数K保持不变 b.反应液的pH保持不变
c.丁醇的浓度保持不变 d.反应液的总质量保持不变
下列措施既能加快该反应速率,又有利于提高产率的是___。
a.合理升高反应温度 b.合理增大反应压强
c.增大水的用量 d.加入稀硫酸作为催化剂
(3)将物质的量浓度相同的草酸溶液与次氯酸钠溶液等体积混合,产生大量无色无味的气体,写出反应的化学方程式____。
(4)已知草酸氢钠溶液显酸性,下列措施能使草酸氢钠溶液中![]() 减小的是___。
减小的是___。
a.通入HCl气体 b.加入草酸晶体 c.通入NH3 d.加入草酸钾晶体
(5)已知:物质的量浓度相同的草酸溶液与亚硫酸钠溶液等体积混合,反应的化学方程式为:①H2C2O4+Na2SO3→NaHC2O4+NaHSO3;草酸溶液与过量的亚硫酸钠溶液混合,反应的化学方程式为:②H2C2O4+2Na2SO3→Na2C2O4+2NaHSO3;过量的草酸溶液与亚硫酸钠溶液混合,反应的化学方程式为:③2H2C2O4+Na2SO3→2NaHC2O4+H2O+SO2↑
根据以上信息判断草酸的两级电离常数(记为K1、K2)与亚硫酸的两级电离常数(记为K3、K4)由大到小的顺序____。
【答案】增大气体在丁醇中的溶解度,以有利于反应进行(或加快反应速率) 0.08mol/(Lmin) bc a NaClO+H2C2O4→NaCl+H2O+2CO2↑ bd K1>K3>K2>K4
【解析】
(1)根据反应①4CO+4C4H9OH+O2![]() 2(COOC4H9)2+2H2O可知,增大压强,有利于增大气体在丁醇中的溶解度,加快化学反应速率;若5min内水的质量增加了7.2g/L,则浓度增加0.4mol/L,则用水表示的反应速率为V(H2O)=
2(COOC4H9)2+2H2O可知,增大压强,有利于增大气体在丁醇中的溶解度,加快化学反应速率;若5min内水的质量增加了7.2g/L,则浓度增加0.4mol/L,则用水表示的反应速率为V(H2O)=![]() =0.08mol/(Lmin);
=0.08mol/(Lmin);
(2)反应(COOC4H9)2+2H2OH2C2O4+2C4H9OH-Q(Q>0)中;
a.温度不变,平衡常数不变,但不一定平衡,故a错误;
b.反应液中有乙二酸,溶液显酸性,反应液的pH保持不变,说明溶液中的乙二酸的浓度不变,则一定平衡,故b正确;
c.丁醇的浓度为变量,丁醇的浓度保持不变,则一定平衡,故c正确;
d.所有反应物和生成物均为液体,根据质量守恒,反应液的总质量总是保持不变,则不一定平衡,故d错误;
下列措施中,
a.合理升高反应温度,反应速率加快,平衡正向移动,故a正确;
b.增大反应压强,由于反应物和生成物均为液体,速率几乎无影响,平衡不移动,故b错误;
c.增大水的用量,水为纯液体,无影响,故c错误;
d.加入稀硫酸作为催化剂,化学反应速率加快,但平衡不移动,故d错误;
答案:bc;a;
(3)根据条件知,草酸具有还原性,次氯酸钠具有强氧化性,发生氧化还原反应,得到CO2气体,反应方程式为:NaClO+H2C2O4→NaCl+H2O+2CO2↑,故答案为:NaClO+H2C2O4→NaCl+H2O+2CO2↑;
(4)a.HCl气体,会与草酸氢根离子反应生成草酸,草酸氢根浓度降低,![]() 增大,故a误;
增大,故a误;
b.加入草酸晶体,使草酸氢根离子浓度增大,故![]() 减小,故b确;
减小,故b确;
c.通入NH3,促进草酸氢根电离,![]() 增大,故错误;
增大,故错误;
d.加入草酸钾晶体,抑制了草酸氢根离子的电离,使草酸根离子浓度增大,![]() 减小,故正确;
减小,故正确;
答案:bd;
(5)根据反应方程式可知,酸性强弱顺序为:H2C2O4>H2SO3>HC2O4->HSO3-,酸性越强,K越大,故K1>K3>K2>K4;
答案:K1>K3>K2>K4。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】三草酸合铁(III)酸钾K3[Fe
(C
2O4)3]3H2O(其相对分子质量为491),为绿色晶体,易溶于水,难溶于酒精。110℃下可完全失去结晶水,230℃时分解。它还具有光敏性,光照下即发生分解,是制备活性铁催化剂的原料。某化学小组制备该晶体,并测定其中铁的含量,进行如下实验:
Ⅰ.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O42H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O42H2O晶体的化学方程式___。检验FeC2O42H2O晶体是否洗涤干净的方法是___。
(2)步骤②中检验Fe2+是否完全转化的操作为___。
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是___。
Ⅱ.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化,MnO4-被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯____,___,___。
(5)写出步骤三中发生反应的离子方程式____。
(6)实验测得该晶体中铁的质量分数为____(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:K=![]() 。
。
(1)请写出该反应的化学方程式:___。
(2)恒温恒容条件下容器中气体的平均相对分子质量、气体的分子总数或混合气体的___不再随时间变化,都可说明该反应已达平衡状态。
(3)该反应的逆反应速率随时间变化的关系如图,t1时的突变一定是因为某种条件的改变,该改变不可能是___;
a.减小H2浓度 b.使用催化剂 c.升高温度

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是
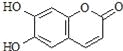
A.与稀H2SO4混合加热不反应
B.不能使酸性高锰酸钾溶液褪色
C.1mol 瑞香素最多能与3mol Br2发生反应
D.1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大多数金属硫化物难溶于水,可溶于硝酸。例如:
①FeS +HNO3(稀)→Fe(NO3)3 +NO↑+S↓+H2O(未配平)
②CuS +HNO3(浓)→CuSO4 +NO2↑+H2O(未配平)
(1)配平反应②的方程式:
__CuS +__HNO3(浓)→__CuSO4 +__NO2↑+__H2O
(2)反应①中若生成3.2g硫,则电子转移___个。
(3)由反应①和②是否能够判断稀硝酸与浓硝酸的氧化性强弱?并说明判断依据。____。
(4)反应①和②所涉及的4种非金属元素中,原子半径由大到小的顺序是____;未成对电子最多的原子核外电子排布式为___。
下列描述,不能用来比较硫、氮两种元素的非金属性强弱的是___。
a.单质与氧气化合的难易程度 b.气态氢化物的稳定性
c.含氧酸的酸性强弱 d.S4N4中共用电子对的偏向
(5)写出①NO ②S ③H2O ④NO2四种物质的沸点由高到低的顺序(用编号回答)____。若要判断NO2分子的极性,你所需要的信息是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,合成线路如图:

(1)C→D的反应类型____,X的化学式是(C6H7BrS),X的结构简式___。
(2)写出C聚合成高分子化合物的结构简式___。
(3)E合成氯吡格雷的反应中,另一个有机产物的结构简式___。
(4)物质A的同系物G,比A多一个碳原子且苯环上一溴代物只有两种的可能结构有___种。
(5)已知①同一个碳原子上连有两个羟基是不稳定的,极易脱水转变为![]() ,②
,②![]() 中氯原子在水溶液中不水解,写出2-氯甲苯(
中氯原子在水溶液中不水解,写出2-氯甲苯( )经两步反应合成A的化学方程式。____,合成A时产生的有机副产物可能是____。
)经两步反应合成A的化学方程式。____,合成A时产生的有机副产物可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。D与A同周期,其最高正价与最低负价代数和为零。A、E可形成AE3型分子,分子中只存在极性键。

(1)B元素在元素周期表中的位置是____________________。
(2)C的离子结构示意图为__________________,用电子式表示AE3的形成过程:_______________________________________。
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有____________。
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)_________________在铜锌硫酸原电池中,若负极减少是13g,则正极产生__________升气体(标准状况)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯( )。
)。
已知有关物质的沸点如下表:
物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 82.4 | 249 | 218 |
Ⅰ.合成苯甲酸异丙酯粗产品:
在如图的三颈烧瓶加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,维持温度85-90℃,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。

(1)仪器A的名称是_______,加入碎瓷片的作用是_______。
(2)制备苯甲酸异丙酯的化学方程式是______。
(3)合成过程中最适合的加热方式是____。
A.酒精灯直接加热 B.油浴
C.水浴 D.砂浴
Ⅱ.粗产品的精制:
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是_______;操作②的名称是_____。

(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用焦炭与石英在高温下氮气流中发生如下反应,3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) +Q(Q>0),可制得一种新型陶瓷材料氮化硅(Si3N4),该材料熔点高,硬度大 ,广泛应用于光伏、轴承、冶金、化工、能源、环保等行业。回答下列问题:
Si3N4(s)+6CO(g) +Q(Q>0),可制得一种新型陶瓷材料氮化硅(Si3N4),该材料熔点高,硬度大 ,广泛应用于光伏、轴承、冶金、化工、能源、环保等行业。回答下列问题:
(1)N2的电子式为____________,Si在元素周期表中的位置是_______________,氮化硅晶体属于__________晶体。
(2)该反应中,还原产物是______________。若测得反应生成22.4 L CO气体(标准状况下),则转移的电子的物质的量为_____________。
(3)该反应的平衡常数表达式K=__________________;若其他条件不变,降低温度,达到新的平衡时,K值____________(填“增大”、“减小”或“不变”,以下同)。CO的浓度_________,SiO2的质量______________。
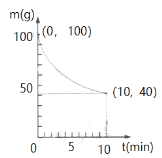
(4)已知在一定条件下的2L密闭容器中制备氮化硅,SiO2(纯度98.5%,所含杂质不与参与反应)剩余质量和反应时间的关系如右图所示。CO在0~10min的平均反应速率为 _______ 。
(5)现用四氯化硅、氮气和氢气在高温下发生反应,可得较高纯度的氮化硅。反应的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com