
分析 (1)①依据亚铁离子的检验方法分析选项;a.KSCN溶液,遇到亚铁离子不变色; b.酸性KMnO4溶液,遇到亚铁离子褪色,草酸根离子也能使酸性KMnO4溶液褪色; c.K3[Fe(CN)6]2溶液 遇到亚铁离子变蓝色;
②用焰色反应,若火焰透过蓝色钴玻璃呈紫色,则说明含有钾元素;
(2)反应中MnO4-→Mn2+,Mn元素由+7价→+2价,得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数,以此分析;
(3)A样品4.91g中,加入足量的3mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0mL,微热,恰好完全反应:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知:n(C2O42-)=$\frac{5}{2}$n(KMnO4),根据离子守恒求出n(K+),样品A[KxFe(Ⅲ)y(C2O4)z•nH2O]中x:1:y:z:n=n(K+):n(Fe3+):n(C2O42-):n(H2O),据此求算A的化学式.
解答 解:(1)①a.KSCN溶液,遇到亚铁离子不变色,不能证明亚铁离子的存在,故a错误;
b.酸性KMnO4溶液,遇到亚铁离子褪色,可以检验亚铁离子的存在,但该溶液中含有草酸根离子,草酸根离子和高锰酸钾也能发生氧化还原反应,所以不能检验A中的亚铁离子,故b错误;
c.K3[Fe(CN)6]溶液遇到亚铁离子变蓝色,可以证明亚铁离子的存在,故c正确;
故答案为:c;
②钾元素属于碱金属元素,通常用焰色反应进行检验,用洁净的铂丝沾取A样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,若能看到紫色火焰,则证明A中含有K元素,
故答案为:用洁净的铂丝沾取A样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,若能看到紫色火焰,则证明A中含有K元素;
(2)反应中MnO4-→Mn2+,Mn元素由+7价→+2价,一得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数=10,由电子守恒和原子守恒可知,反应为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,
故答案为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O;
(3)n(H2O)=$\frac{4.910g-4.370g}{18g/mol}$=0.03000mol,n(Fe3+)=2n(Fe)=2×$\frac{0.2800g}{56g/mol}$=0.01000mol,由方程式2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O知:n(C2O42-)=$\frac{5}{2}$×n(KMnO4)=$\frac{5}{2}$×0.5000mol/L×0.02400L=0.03000mol,根据离子电荷守恒:n(K+)+3n(Fe3+)=2n(C2O42-),n(K+)=0.03000mol,n(K+):n(Fe3+):n(C2O42-):n(H2O)=0.03000mol:0.01000mol:0.03000mol:0.03000mol=3:1:3:3,所以:x:y:z:n=3:1:3:3,A为K3Fe(C2O4)3•3H2O,
答:化合物A的化学式为:K3Fe(C2O4)3•3H2O.
点评 本题考查离子的检验、化学式的求算,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意把握实验的基本方法,掌握通过计算分析确定化学式的方法,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 二氧化硫具有氧化性,可用于漂白纸浆 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是| A. | 普伐他汀分子中有4种含氧官能团 | |
| B. | 每个普伐他汀分子中含有13个手性碳原子 | |
| C. | 在一定条件下,普伐他汀能发生加成、取代、消去、缩聚反应 | |
| D. | 普伐他汀可以和NaOH溶液、Na2CO3溶液反应,还可以和酸性KMnO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H+数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
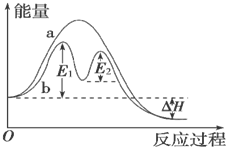
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
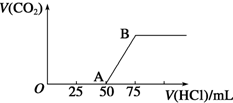 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056 L | |
| D. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com