
下列实验方案设计中,可行的是( )
A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B.用萃取的方法分离汽油和煤油
C.用溶解、过滤的方法分离硝酸钾和氯化钠固体的混合物
D.将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
在一个绝热的密闭容器中,发生反应:X(g)+3Y(g)  2Z(g) △H>0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
2Z(g) △H>0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A. 等压时,通入惰性气体,Z的物质的量不变
B. 等压时,通入Z气体,容器内温度改变
C. 等容时,通入惰性气体,反应速率不变
D. 等容时,通入Z气体,Y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙烯为原料合成化合物C的流程如图所示:
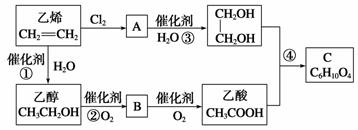
(1) B中含有的官能团名称为________________;A的结构简式:___________________。
(2)写出乙醇的同分异构体的结构简式:___________________________________。
(3)写出反应②和④的化学方程式:
②_____________________________________________________________________;
④_____________________________________________________________________。
(4)写出B与新制Cu(OH)2悬浊液反应的化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
_____________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.铂 D.玻璃
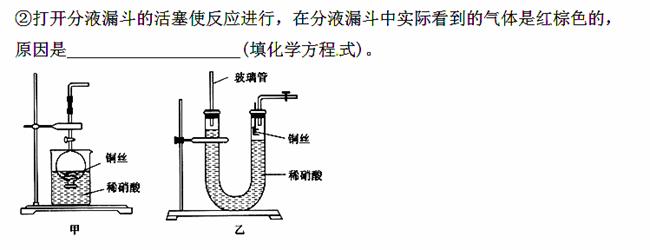 (3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是___________________________________。
②让反应停止的操作方法及原因是________________________。
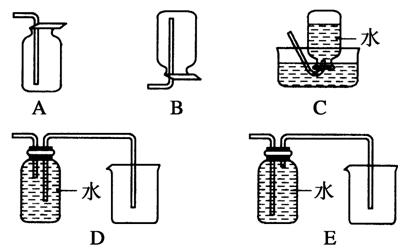
(4)以下收集NO气体的装置,合理的是________(填选项代号)。
(5)假设实验中12.8 g Cu全部溶解,需要通入标况下________mL O2才能使NO全部溶于水。
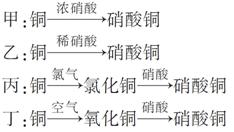
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列涉及有机物的性质的说法错误的是
A.苯不能使KMnO4溶液褪色,甲苯使KMnO4溶液褪色
B.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝变成黑色
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
D.HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有____▲__性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+______▲____。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O+I2===S4O+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
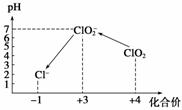
请回答:
①操作Ⅰ中反应的离子方程式是_____________▲_________________。
②确定操作Ⅱ完全反应的现象是_____________▲_________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______▲___________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____▲____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知反应过程中发生如下变化:K2Cr2O7→CrCl3,则下列说法不正确的是
A.由此反应可知氧化性K2Cr2O7>Cl2
B.氧化剂和还原剂的物质的量之比为1:6
C.当转移0.2mol电子时,生成的还原产物的物质的量为0.1mol
D.发生氧化还原反应的氯元素与参加反应的氯元素的比为3:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com