
| A. | 若浓硫酸不慎洒落在皮肤上应立即用干布拭去,再用大量水冲洗 | |
| B. | 可使蔗糖变黑,体现了浓硫酸的吸水性 | |
| C. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | |
| D. | 可使胆矾变白,体现了浓硫酸的脱水性 |
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的盐酸与0.1 mol•L-1的氨水混合,若溶液显中性,则V(盐酸)<V(氨水) | |
| B. | 0.1 mol•L-1的醋酸与等浓度等体积NaOH反应后的溶液中,CH3COOH和CH3COO-浓度关系为:c(CH3COOH)+c(CH3COO-)=0.1 mol•L-1 | |
| C. | pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水) | |
| D. | 已知酸性:HCOOH>HCN,等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
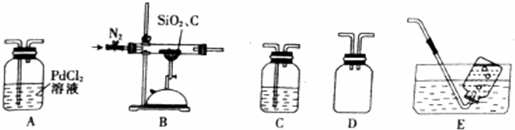
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY | B. | XY2 | C. | XY4 | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
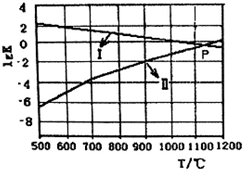 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
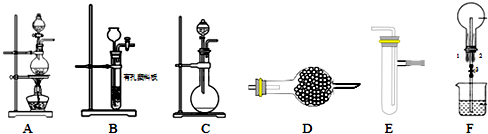
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com