
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C6H14且含有三个甲基 | 2 |
| B | 分子式为C5H10,不能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,不能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2能与NaHCO3反应产生气体 | 2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、化学式为C6H14的烷烃分子存在碳骨架异构,据此书写符合条件的同分异构体;
B、不能使溴的四氯化碳溶液褪色,说明C5H10是环烷烃;
C、不能与Na反应生成氢气,说明C4H10O为醚类,醚分子中含有-O-;
D、能与NaHCO3反应说明为羧酸,依据丁烯基的个数判断即可.
解答 解:A.在化学式为C6H14的烷烃分子中,含有三个甲基的同分异构体分别是:2-甲基戊烷和3-甲基戊烷,2种同分异构体,故A正确;
B.分子式为C5H10,不能使溴的四氯化碳溶液褪色,则C5H10是环烷烃:五元环是环戊烷 ,四元环是甲基环丁烷
,四元环是甲基环丁烷 ,三元环时,存在1,2-二甲基环丙烷
,三元环时,存在1,2-二甲基环丙烷 ,乙基环丙烷
,乙基环丙烷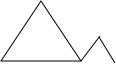 ,1,2-二甲基环丙烷
,1,2-二甲基环丙烷 ,共有5种,故B正确;
,共有5种,故B正确;
C、分子式为C4H10O,不能与Na反应生成氢气,说明为醚类,可能结构有3种:CH3OCH2CH2CH3,CH3CH2OCH2CH3,CH3OCH(CH3)2,故C错误;
D、能与NaHCO3反应说明为羧酸,C4H8O2可写成C3H7COOH,丙基有2种,即共有2种酸,故D正确;
故选C.
点评 本题主要考查了同分异构体数目的判断,题目难度不大,注意掌握常见有机物结构与性质,明确同分异构体的概念及求算方法,侧重于考查学生的分析能力和应用能力,难度中等.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤炭经气化、液化和干馏等处理后,可转化为清洁能源 | |
| B. | “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应 | |
| C. | 地沟油和矿物油的主要化学成分相同 | |
| D. | 聚氯乙烯可以用作食品包装袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 常温下,将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水多 | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
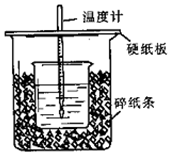 50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
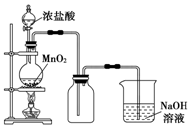 实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 同分异构体数目 |
| A | CH2F2 | 2种 |
| B | C2H6O | 3种 |
| C | C3H7Cl | 4种 |
| D | C4H8 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
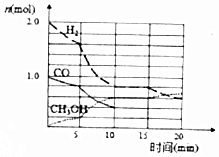 工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com