
| A.单位时间内消耗nmolSO2,同时生成nmolSO3 |
| B.v逆(SO3)=2v正(O2) |
| C.容器内气体的密度保持不变 |
| D.v(SO2)=v(SO3) |
科目:高中化学 来源:不详 题型:单选题
| A.2∶3∶2 | B.2∶2∶3 | C.1∶3∶2 | D.3∶1∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g),达到化学平衡后,C的体积分数为
xC(g),达到化学平衡后,C的体积分数为 。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是  时,按1.5 mol A、l mol C作为起始物质,达到平衡后, C的体积分数仍为
时,按1.5 mol A、l mol C作为起始物质,达到平衡后, C的体积分数仍为
 2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为
2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为
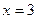 时,l mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为
时,l mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为
 ,则
,则 为2或3
为2或3查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ |
| C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min) |
| D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M、N、Q三种物质的浓度一定相等 |
| B.M、N全部变成了Q |
| C.反应混合物各组分的浓度不再变化 |
| D.反应已经停止 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2完全转化为SO3 |
| B.消耗2molSO2的同时生成2molSO3 |
| C.SO2、O2与SO3的物质的量之比为2:1:2 |
| D.SO2、O2与SO3的浓度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.各物质的浓度不随时间变化 |
| B.容器的压强不再变化 |
| C.B的生成速率和D的生成速率为3:1 |
| D.混合气体的密度不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com