
| A. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O | |
| C. | 向苯酚钠溶液中通入少量CO2: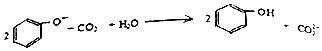 | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.双氧水能够将碘离子氧化成碘单质,不会放出氧气;
C.苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢钠;
D.二者物质的量相等,反应生成碳酸钡沉淀、一水合氨和水.
解答 解:A.氯化亚铁溶液中通入氯气,反应生成氯化铁,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.在海带灰的浸出液(含有I-)中滴加H2O2,二者发生氧化还原反应生成I2,正确的离子方程式为:2I-+H2O2+2H+=I2+2H2O,故B错误;
C.向苯酚钠溶液中通入少量CO2,由于苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子,正确的离子方程式为:C6H6O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合,反应的离子方程式为:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:选择题
| A. | A.运石油的油罐车上应贴  标志,并由专人押运 标志,并由专人押运 | |
| B. | 不慎将酒精洒到桌面上引起着火,可用水扑灭 | |
| C. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用硼酸稀溶液冲洗 | |
| D. | 右图装置可分离CH3COOC2H5和碳酸钠饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
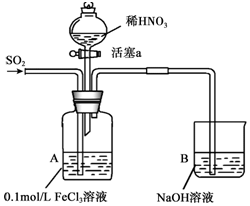 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和④ | B. | ②和③ | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8 NA | |
| B. | 标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5 NA | |
| C. | 8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1 NA | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数为0.05 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 醋酸溶解鸡蛋壳:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学家可以在微观层面上操纵分子和原子,组装分子材料 | |
| B. | 化学是一门具有创造性的科学,化学的特征就是认识分子和制造分子 | |
| C. | 化学是在原子、分子的水平上研究物质的一门自然科学 | |
| D. | 化学注重理论分析、推理,而不需要做化学实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com