
分析 由离子方程式可知几种离子的还原能力强弱顺序为I->Fe2+>Br-,
(1)氯气不足,应先氧化还原性强的离子,结合电子守恒计算;
(2)根据电子守恒,氯气可完全氧化I-、Fe2+,氧化部分Br-;
(3)三价铁具有氧化性,能将碘离子氧化.
解答 解:由离子方程式可知几种离子的还原能力强弱顺序为I->Fe2+>Br-,
(1)含有1mol FeI2和2mol FeBr2的溶液中含有2molI-、3molFe2+,2molBr-,通入2mol Cl2,可共得到4mol电子,可氧化2molI-、2molFe2+,
故答案为:I-、Fe2+;2 mol、2 mol;
(2)含有1mol FeI2和2mol FeBr2的溶液中含有2molI-、3molFe2+,2molBr-,通入3mol Cl2,可共得到6mol电子,可氧化2molI-、3molFe2+,1molBr-,
故答案为:I-、Fe2+、Br-;1 mol、3 mol、0.5 mol;
(3)三价铁具有氧化性,能将碘离子氧化,S2O82-能将亚铁离子氧化,原理为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+,
故答案为:2Fe3++2I-═2Fe2++I2 S2O82-+2Fe2+═2SO42-+2Fe3+.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从元素的化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
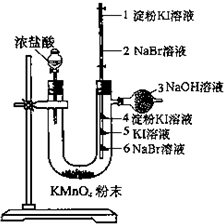 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
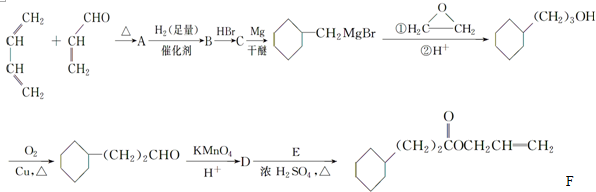
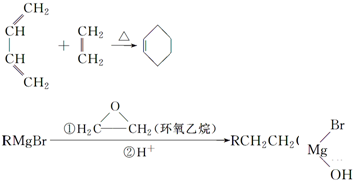

 .
. .
.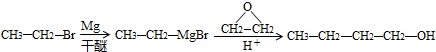 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
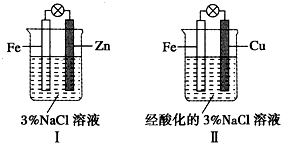
| A. | Ⅰ是验证牺牲阳极的阴极保护法的实验装置 | |
| B. | Ⅰ和Ⅱ中负极反应式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com