
碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合)下列说法正确的是
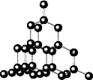

金刚石 石墨
 A.现代科技已经实现了石墨制取金刚石,该过程属于化学变化
A.现代科技已经实现了石墨制取金刚石,该过程属于化学变化
B.相同质量的金刚石与石墨晶体中,所含共价键数相同
C. 估计金刚石与石墨的熔沸点均较高,硬度均较大
估计金刚石与石墨的熔沸点均较高,硬度均较大
D.根据:C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·mol-1
C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
说明金刚石比石墨稳定,石墨转变为金刚石为放热反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:038
已知298 K时由石墨生成金刚石反应的ΔH=1.895 KJ·mol-1,ΔH–T ΔS=2.866 kJ·mol-1,又知石墨的熵S石=5.694 J·mol-1·K-1,求
金刚石的熵S金,这两种碳的同素异形体的原子结构那种排列更有序?(化学反应的熵变是产物的总熵与反应物的总熵之差)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com