
| A. | 可能是不同的分子与原子 | B. | 可能是不同的离子 | ||
| C. | 可能是一种离子和一种分子 | D. | 可能是某位素的同位素原子 |
分析 构成物质的基本粒子有:分子、原子、离子,在分子和原子中质子数等于电子数,对于离子来说质子数与核外电子数是不相同的.
解答 解:A.两种不同的分子的质子数和电子数可能均相等,如:H2O分子和NH3分子都含有10个质子,10个电子,故A正确;
B.不同的离子的质子数和电子数可能均相等,如:F-和OH-,故B正确;
C.一种分子和一种离子的质子数和电子数不可能均相等,因为对于分子来说质子数和电子数是相等的,对于离子来说质子数和电子数是不相等的,所以一种分子和一种离子要么质子数相等,要么电子数相等,不可能质子数和电子数都相等,故C错误;
D.同位素原子的质子数和电子数肯定相等,如:12C、13C,故D正确.
故选C.
点评 本题主要考查了分子、离子中质子数和电子数的计算,难度不大,要熟记对于分子和原子来说质子数和电子数都相等,对于离子来说质子数与电子数不相等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| B. | 该反应的氧化剂只有Cu2O | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 每生成19.2gCu,反应中转移1.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN的电离方程式:HCN?H++CN- | |
| B. | NaCN是一种弱电解质 | |
| C. | NaCN溶液中一定存在:c(Na+)>c(CN-) | |
| D. | 0.1mol•L-1NaCN溶液中:c(CN-)+c(HCN)=0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
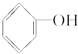 +2H2SO4(浓)$\stackrel{△}{→}$
+2H2SO4(浓)$\stackrel{△}{→}$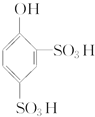
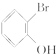 (无机试剂任选).
(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4----腐蚀品 | B. | CH4---易燃液体 | ||
| C. | 白磷---易自燃物品 | D. | HClO---氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | NaAlO2 | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | Al2O3 | 两性氧化物 | 氧化物 |
| D | 单质参与反应 | 置换反应 | 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用作净水剂 | |
| B. | 酒精可用于杀菌、消毒 | |
| C. | 碳酸钙是陶瓷文物的主要成分 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com