
下列各组微粒,氧化性由强到弱排列顺序正确的是( )
A.F-、Cl-、Br-、I- B. Na+、Zn2+、H+、Cu2+
C. F2、Cl2、Br2、I2 D. Cu、Fe、Al 、Mg
科目:高中化学 来源: 题型:
 煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种
 脱硫技术的原理为FeS2 Fe2++SO42—
脱硫技术的原理为FeS2 Fe2++SO42—
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
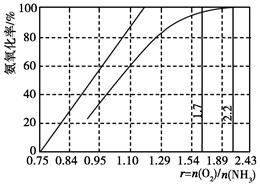
(4 )工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是 ( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色 ②向FeCl2溶液中加入氯水,再加入KSCN溶液呈红色 ③向KMnO4溶液中加入浓盐酸后,振荡后紫色褪去
A.I2>Cl2>Fe3+>MnO B.MnO
B.MnO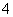 >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
C.Cl2>I2>Fe3+>MnO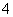 D.Fe3+>MnO
D.Fe3+>MnO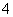 >Cl2>I2
>Cl2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑ 还原反应:MnO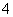 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:________________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为
;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不能发生的是( )
A.CaCO3+2CH3COOH====(CH3COO)2Ca+H2O+CO2↑
B.SiO2+2NaOH====Na2SiO3+H2O
C.AgNO3+HCl====AgCl↓+HNO3
D.2HCl+Cu====CuCl2+ H2↑
H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
1)向NaHSO4溶 液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式
液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式 :_________________________________________________
:_________________________________________________ ______。
______。
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,请写出发生反应的离子方程式:____________________________________________。
(3)向Ba(OH)2溶液中逐 滴加入明矾[KAl(SO4)2·12H2O]至溶液中Ba2+恰好完全沉淀,反应的离子方程式是:_________________________________________。
滴加入明矾[KAl(SO4)2·12H2O]至溶液中Ba2+恰好完全沉淀,反应的离子方程式是:_________________________________________。
在以上溶液中 继续滴加明矾溶液,请写出此步反应的离子方程式:_________。
继续滴加明矾溶液,请写出此步反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)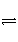
 1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol·L-1 pH=7.82的NH4HCO3溶液中:c(HCO )>c(NH
)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合:
[c(NH )+c(H+)]>[c(NH3·H2O)+c(OH-)]
)+c(H+)]>[c(NH3·H2O)+c(OH-)]
C.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合:
2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com