
| n |
| V |
| 36g |
| 136g |
| 9 |
| 34 |
| 58.5g | ||
|
| ||
| m |
| ρ |
| 221g |
| 1200g/L |
| 1mol |
| 0.184L |


科目:高中化学 来源: 题型:
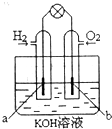 某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L CH3CHO中含有的分子数约为6.02×1023 |
| B、56g铁与稀HNO3充分反应,转移电子数为0.3NA |
| C、常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数约为3×6.02×1023 |
| D、80 g NH4NO3晶体中含有NH4+小于 6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有糖类物质都有甜味,但不一定都溶于水 |
| B、葡萄糖和果糖性质不同,但分子式相同 |
| C、葡萄糖和蔗糖不是同分异构体,但属于同系物 |
| D、葡萄糖、果糖和蔗糖都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、4g | C、6g | D、8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
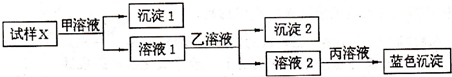
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油和水、CCl4和水两组物质,都能用分液漏斗进行分离 |
| B、在1L 5.0mol/L HCl溶液中取出了10 mL,取出的HCl溶液其浓度为5.0 mol/L |
| C、分散系根据分散质粒子大小可分为溶液、胶体、浊液 |
| D、0.5 molCuO的摩尔质量为40g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com