
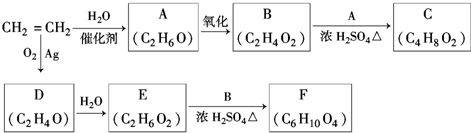
 ,该反应的类型为酯化反应;
,该反应的类型为酯化反应;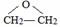 ;
;分析 乙烯与水加成生成A,A为C2H5OH,乙醇催化氧化生成B,结合B的分子式可知B为CH3COOH,乙酸与乙醇反应生成C,C为CH3COOC2H5,乙烯与氧气反应生成D(C2H4O),D为环氧乙烷 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯( ),据此解答.
),据此解答.
解答 解:乙烯与水加成生成A,A为C2H5OH,乙醇催化氧化生成B,结合B的分子式可知B为CH3COOH,乙酸与乙醇反应生成C,C为CH3COOC2H5,乙烯与氧气反应生成D(C2H4O),D为环氧乙烷 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯( ).
).
(1)由上述分析可知,A为C2H5OH,名称为乙醇,故答案为:乙醇;
(2)A生成B是乙醇被氧化生成乙酸,反应化学方程式为:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O等,
故答案为:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O等;
(3)B和A反应是乙酸与乙醇反应生成乙酸乙酯,反应方程式为: ,该反应的类型为酯化反应;
,该反应的类型为酯化反应;
故答案为: ;酯化反应;
;酯化反应;
(4)由上述分析可知,D为环氧乙烷,结构简式为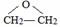 ,故答案为:
,故答案为: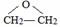 ;
;
(5)由上述分析可知,F为二乙酸乙二酯,结构简式为CH3COOCH2CH2OOCCH3,
故答案为:CH3COOCH2CH2OOCCH3;
(6)D为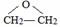 ,同分异构体的结构简式为CH3CHO或CH2=CHOH,
,同分异构体的结构简式为CH3CHO或CH2=CHOH,
故答案为:CH3CHO; CH2=CHOH.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,根据乙烯与D的分子式与转化关系,判断D的结构是解题的关键,(2)中方程式书写为易错点,可以用重铬酸钾会高锰酸钾氧化乙醇,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 左、下方区域的金属元素 | |
| B. | 右、上方区域的非金属元素 | |
| C. | 金属元素与非金属元素分界线附近的元素 | |
| D. | 过渡元素中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl Na+${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$ | B. | H2S H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | ||
| C. | N2 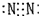 | D. | NH4I 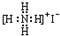 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属性比硫弱 | B. | 氢化物比HBr稳定 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
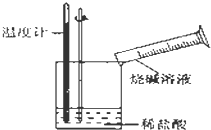 某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.
某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
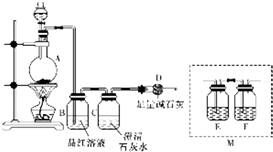 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
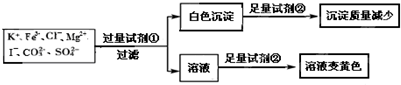
| A. | 该溶液中一定有I-、CO32-、SO42-、K+ | |
| B. | 试剂①为硝酸钡 | |
| C. | 通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl- | |
| D. | 试剂②一定为盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com