
| A、弱电解质的电离达到平衡状态后,电离就停止了 |
| B、分子的消耗速率和离子的生成速率相等,说明弱电解质的电离达到平衡状态 |
| C、弱电解质的电离达到平衡状态后,分子和离子的浓度相等 |
| D、弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动 |


科目:高中化学 来源: 题型:
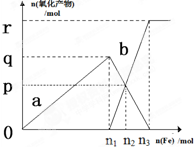 含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )
含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )| A、a是Fe(NO3)2 |
| B、n1=0.80 |
| C、p=0.60 |
| D、n3=1.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的Fe粉与少量的氯气反应可得到氯化亚铁固体 |
| B、Cu、Mg、Al都能与氢氧化钠溶液作用生成氢气 |
| C、铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量盐酸 充分反应过滤除去 |
| D、常温下,铝制品用浓硫酸或浓硝酸处理表面钝化,可耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气的密度增大了 |
| B、混合体系的压强增大了 |
| C、正逆反应的速率相等,且都比原平衡状态的速率增大了 |
| D、A气体在混合气中的含量升高了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.21mol?L-1 |
| B、0.42mol?L-1 |
| C、0.56mol?L-1 |
| D、0.26mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取20.0mL 0.500 0 mol?L-1 H2SO4溶液于烧杯中,加80 mL配制成0.100 0 mol?L-1 H2SO4溶液 |
B、选用 配制100 mL 0.100 0 mol?L-1 KMnO4溶液 配制100 mL 0.100 0 mol?L-1 KMnO4溶液 |
| C、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| D、用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是由氢气和氧气组成 |
| B、它由两个氢元素和两个氧元素组成 |
| C、每个H2O2分子是由氢元素和氧元素组成 |
| D、每个H2O2分子是由2个氢原子和2个氧原子构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com