
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能级电子全充满 |
 .
. .
.分析 前四周期元素A、B、C、D、E、F原子序数依次增大,A的2p能级电子半充满,最外层电子数排布为2s22p3,则A为氮元素,B与A同周期,B的原子序数大于氮,且原子核外有2个未成对电子,最外层电子数排布为2s22p4,则B为氧元素,C基态原子核外有6个原子轨道排有电子,且只有1个未成对电子,核外电子排布为1s22s22p63s1,则C为钠元素,在前四周期元素中E元素基态原子未成对电子数最多,只能处于第四周期,外围电子排布为3d54s1,则E为铬元素,D其基态原子外围电子排布为msnmpn+2,s能级容纳2个电子,则s=2,故D为第ⅥA族元素,原子序数小于铬大于钠,则D为硫元素,F基态F+各能层电子全充满,原子序数大于Cr,则原子核外电子数为2+8+18+1=29,则F为铜元素,据此解答.
解答 解:前四周期元素A、B、C、D、E、F原子序数依次增大,A的2p能级电子半充满,最外层电子数排布为2s22p3,则A为氮元素,B与A同周期,B的原子序数大于氮,且原子核外有2个未成对电子,最外层电子数排布为2s22p4,则B为氧元素,C基态原子核外有6个原子轨道排有电子,且只有1个未成对电子,核外电子排布为1s22s22p63s1,则C为钠元素,在前四周期元素中E元素基态原子未成对电子数最多,只能处于第四周期,外围电子排布为3d54s1,则E为铬元素,D其基态原子外围电子排布为msnmpn+2,s能级容纳2个电子,则s=2,故D为第ⅥA族元素,原子序数小于铬大于钠,则D为硫元素,F基态F+各能层电子全充满,原子序数大于Cr,则原子核外电子数为2+8+18+1=29,则F为铜元素.
(1)E为铬元素,核外电子数为24,运动状态均不相同,电子排布式为1s22s22p63s23p63d54s1,F为铜元素,位于元素周期表第四周期ⅠB族,其基态原子的外围电子排布式为3d104s1,价电子排布图为 ,
,
故答案为:24; 1s22s22p63s23p63d54s1;第四周期ⅠB族; ;
;
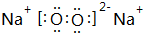
(2)B和C可形成一种同时含有共价键和离子键的化合物为Na2O2,其电子式为  ,
,
故答案为: ;
;
(3)元素随着非金属性的增强,第一电离能也增大,但由于氮元素最外层p轨道上电子处于半满状态,是一种稳定结构,所以氮的第一电离能高于相邻的同周期元素,所以A、B、C、D四种元素第一电离能由大到小的顺序为 N>O>S>Na,
电子层数越多,离子半径越大,电子层数结构相同,核电荷数越大,离子半径越小,所以B、C、D三种元素的简单离子的半径由大到小的顺序为S2->O2->Na+,
故答案为:N>O>S>Na; S2->O2->Na+;
(4)许多金属盐都可以发生焰色反应,是因为激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量,
故答案为:激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、微粒半径比较、电子能级跃迁等知识点,注意对基础知识的理解掌握.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NA个氢气分子所占的体积为22.4L | |
| B. | 常温下,22.4 L NO2中所含的氧原子数为2 NA | |
| C. | 14 g氮气所含的N原子数为NA | |
| D. | 标准状况下,22.4 L水所含的H2O分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油属于混合物,石蜡油属于纯净物 | |
| B. | 地沟油属于酯类,石蜡油属于烃类 | |
| C. | 地沟油可以用来制肥皂,石蜡油是石油裂解的产品 | |
| D. | 地沟油属于高分子化合物,石蜡油属于小分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
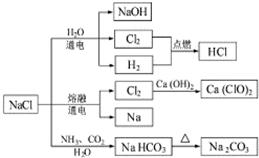 NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )
NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的小 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下液氯能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2易用于溴苯中 | B. | S易用于CS2中 | ||
| C. | S易溶于Na2S溶液中 | D. | AgF易溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3v(H2)正=2v(NH3)逆 | B. | 容器内的总压强不再随时间而变化 | ||
| C. | N2、H2、NH3的分子数之比为1:3:2 | D. | 混合气体的密度不再随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com