
【题目】常温常压下,某烃和氧气的混合气体4L,点燃后恰好完全燃烧,通过浓硫酸后恢复到原来状态,体积变为2L。则符合题意的某烃为( )
A.C4H8B.C3H8C.C2H2D.CH4
科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。

(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
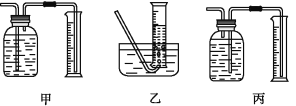
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,在元素周期表中的位置是________。
(2)N元素非金属性比As强,下列说法正确的是_______
①热稳定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半径:N<As
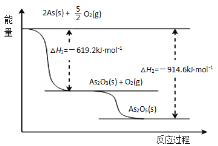
(3)请依据如图信息写出As2O5分解为As2O3的热化学方程式_______。
(4)查阅文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如图:

已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的离子方程式为_______。
③过程Ⅲ得到纯净As2O3固体的系列操作包括_____、_____、_____。
④过程Ⅲ中,其它条件相同时仅改变溶液pH,发现酸性越强,As2O3的产率越高,可能的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如图所示。据图判断不正确的是( )

A. I是盐酸,Ⅱ是醋酸
B. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同
C. a、b、c三点KW的数值相同
D. 溶液的导电性a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在加热条件下,乙醇转化为有机物R的过程如图所示,其中错误的是( )
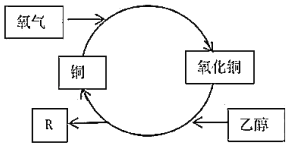
A.R的化学式为C2H4O
B.乙醇发生了氧化反应
C.反应过程中固体有红黑交替变化的现象
D.乙二醇(HOCH2CH2OH)不能发生类似反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol CH4 和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:
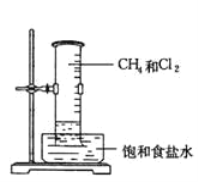
(1)片刻后试管中的现象为:
①试管内气体的颜色变浅,②试管壁上出现_________________________、③试管内__________________、____________________。
(2)在反应结束后,试管内的产物最多的是___________,空间构型呈正四面体的产物为___________。
(3)若(2)中生成的四种有机产物的物质的量相同,则反应消耗的Cl2的物质的量为________mol。
(4)与CH4相邻同系物的结构简式为_______________该同系物与Cl2发生一氯取代反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为Mr的气态化合物V L(标准状况)溶于mg水中,得到溶液的质量分数为w%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法不正确的是( )
A.溶液密度ρ可表示为![]()
B.物质的量浓度c可表示为![]()
C.溶液的质量分数w%可表示为![]()
D.相对分子质量Mr可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.电解水时氢气与氧气的体积比为2:1,原因是气体的体积主要取决于分子间距,而同温同压时气体的间距基本相等
B.碳酸分步电离以第一步为主,第二步为次,原因之一是第二步电离时碳酸氢根带负电荷,而电离出的氢离子为正电荷
C.苯酚显弱酸性可与氢氧化钠溶液反应,是因为羟基活化了苯环
D.可通过如图(比例模型)判定醋酸是弱电解质

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,NaN3易溶于水,微溶于乙醇,易溶于乙醚,水溶液中遇酸放出有毒的HN3;工业上采用“亚硝酸甲酯——水合肼法”制备叠氮化钠的生产流程如图:

回答下列问题:
(1)写出亚硝酸甲酯合成釜中生成CH3ONO的化学反应方程式:______。
(2)亚硝酸甲酯以气体进入叠氮环合塔中生成叠氮化钠的反应方程式为______。
(3)水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为______;叠氮环合塔中滴加的烧碱溶液要适当过量,目的是_____;生产流程中操作x的名称是______。
(4)操作y对溶液加热蒸发至溶液体积的![]() ,有NaN3晶体析出,洗涤晶体可以用___。
,有NaN3晶体析出,洗涤晶体可以用___。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
该生产过程中可循环使用的物质是_______。
(5)生产中有HN3生成,请设计实验证明HN3为弱酸:_______。
(6)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5 g NaN3,理论上需加入0.5 mol·L-1的NaClO溶液_____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com