
分析 (1)0.4g白色沉淀为碳酸钙,其物质的量为0.004mol,当二氧化碳不足时,根据C原子守恒可知二氧化碳的物质的量为0.004mol,当二氧化碳部分过量时,氢氧化钙完全反应,其中生成了0.004mol碳酸钙和0.006mol碳酸氢钙,结合反应方程式计算出消耗二氧化碳的总物质的量;
(2)①根据n=$\frac{V}{{V}_{m}}$计算出二氧化碳的物质的量,氢氧化钡优先反应,再根据反应CO2+Ba(OH)2═BaCO3↓+H2O计算出消耗氢氧化钡的物质的量,然后根据c=$\frac{n}{V}$计算出氢氧化钡的物质的量及氢氧化钡中氢氧根离子浓度,最后根据氢氧根离子总浓度计算出氢氧化钠的浓度;
②根据n=$\frac{V}{{V}_{m}}$计算出二氧化碳的物质的量,结合氢氧根离子浓度偏低反应产物,最后根据c=$\frac{n}{V}$计算出计算出溶液中阴离子(OH-除外)的物质的量浓度.
解答 解:(1)0.4g白色沉淀为碳酸钙,其物质的量为:$\frac{0.4g}{100g/mol}$=0.004mol,存在两种情况:二氧化碳不足和部分过量,
当二氧化碳完全转化成碳酸钙时,根据C原子守恒,生成沉淀时消耗的二氧化碳的物质的量为0.004mol;
当二氧化碳部分过量,则0.01mol氢氧化钙完全反应,反应产物为0.004mol碳酸钙和0.006mol碳酸氢钙,根据C原子守恒可知消耗二氧化碳的总物质的量为:0.004mol+0.006mol×2=0.016mol,
故答案为:0.004mol;0.016mol;
(2)①0.56L (标准状态)二氧化碳的物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,通入二氧化碳后先发生反应CO2+Ba(OH)2═BaCO3↓+H2O,当生成沉淀达到最大时通入二氧化碳的物质的量为0.025mol,则氢氧化钡的物质的量为0.025mol,浓度为:$\frac{0.025mol}{0.1L}$=0.25mol/L;
0.25mol/L的氢氧化钡溶液中含有氢氧根离子的浓度为:0.5mol/L,则氢氧化钠溶液的浓度为:1mol/L-0.5mol/L=0.5mol/L,
答:原溶液中氢氧化钠和氢氧化钡的物质的量浓度分别为0.05mol/L、0.25mol/L;
②当通入的CO2气体总体积为2.24L (标准状态)时,二氧化碳的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,100mL 1mol/L的氢氧根离子的物质的量为:1mol/L×0.1L=0.1mol,n(C02):n(OH-)=0.1mol:0.1mol=1:1,则氢氧根离子与二氧化碳恰好反应生成碳酸氢根离子,其物质的量为0.1mol,
则反应后的溶液中碳酸氢根离子的浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,
答:溶液中阴离子HCO3-的物质的量浓度为1mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积、物质的量浓度等之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
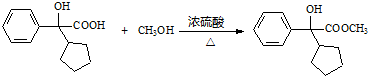 .
.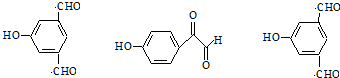 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com