
 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | / | |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 待硬质玻管冷却到室温后 | |
| ② | 过量的稀盐酸 通入装少量品红溶液的试管 | 若品红褪色则固体中含有Na2SO3 |
| ③ | 取②充分反应后的溶液滴入适量BaCl2溶液 | 若有白色沉淀生成则固体中含有Na2SO4 |


科目:高中化学 来源: 题型:
| A、w2>2w1 |
| B、2w1=w2 |
| C、2w2=w1 |
| D、w1<w2<2w1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
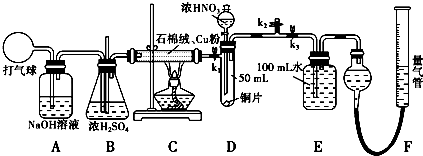
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com