
| A、增加A的物质的量 | B、加压 |
| C、升温 | D、使用催化剂 |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2L氧气中所含有的原子数为NA |
| B、同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
| C、物质的量浓度为0.5mol?L-1的MgCl2溶液中,含有Cl-个数为NA |
| D、54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸和氯氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| B、碳酸钠与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O |
| C、铁钉放入硫酸铁溶液中:Fe+Fe3+=2Fe2+ |
| D、Ca(NO3)2溶液和Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力发展火力发电,解决电力紧张问题 |
| B、对杂草、生活垃圾等有机废弃物进行露天焚烧处理 |
| C、汽车安装尾气处理装置,减少大气污染 |
| D、在屋顶安装太阳能热水器为居民提供生活用热水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH和Na2CO3都属于碱 |
| B、K2CO3和KHCO3都属于盐 |
| C、H2SO4和HNO3都属于酸 |
| D、Na2O和SiO2都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌片作负极,发生还原反应 |
| B、电流方向是由锌片流向铜片 |
| C、锌片质量逐渐减少,铜片上有气泡产生 |
| D、电解质溶液的氢离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
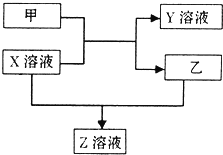 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com