
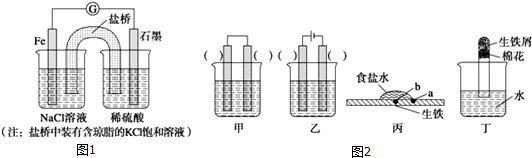
分析 (1)①图1为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2;原电池中阴离子向负极移动;
②Fe和H2SO4之间的反应结合电解池和原电池的原理分析回答;
(2)装置丙中,根据易生锈的是构成原电池作负极的分析,根据吸氧腐蚀消耗了空气中的氧气,使试管内压强降低,则大气压使试管中液面会上升.
解答 解:(1)①图中为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2↑;原电池中阴离子向负极移动,所以左侧烧杯中的c(Cl-)增大;
故答案为:2H++2e-=H2↑;增大;
②Fe和H2SO4之间的反应,如果设计电解池实现,金属铁作阳极,阳极:Fe-2e-=Fe2+,电解质为硫酸,阴极是氢离子放电,电极反应为2H++2e-=H2↑,即阳极为铁,阴极为C;如果设计原电池实现,金属铁作负极,负极:Fe-2e-=Fe2+,电解质为硫酸,正极是氢离子放电,电极反应为2H++2e-=H2↑,即负极为铁,正极为C;甲:左边为Fe,右边为C;乙:左边为Fe,右边为C;故答案为:Fe,C;
(2)装置丙中,a点与空气接触符合构成原电池的条件,易生锈;装置丁中发生吸氧腐蚀消耗了空气中的氧气,生铁表面生成红棕色锈斑,使试管内压强降低,则大气压使试管中液面会上升;故答案为:a;生铁表面生成红棕色锈斑,试管内液面上升.
点评 本题主要考查了原电池、电解池的原理及其应用,难度不大,重点要掌握基本原理.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
 NPG(新戊二醇)是一种可用作太阳能储存热量的物质.已知:NPG的结构式如图.有关NPG的说法不正确的是( )
NPG(新戊二醇)是一种可用作太阳能储存热量的物质.已知:NPG的结构式如图.有关NPG的说法不正确的是( )| A. | NPG的分子式为C5H12O2 | B. | NPG沸点比乙二醇的高 | ||
| C. | NPG一定条件下能发生消去反应 | D. | NPG的氧化产物可发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中一定含有氧元素 | ||
| C. | 该化合物中碳、氢原子个数比为1:2 | D. | 该有机物的分子式为C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种 | B. | 五种 | C. | 六种 | D. | 七种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式:O2+2H2O+4e-═4OH- | |
| B. | 负极反应式:CH4+8OH--8e-═CO2+6H2O | |
| C. | 随着放电的进行,溶液中的氢氧根离子浓度不变 | |
| D. | 放电时溶液中的阴离子向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
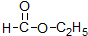 酯; ②
酯; ②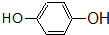 酚;
酚;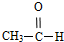 醛;④
醛;④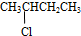 卤代烃;⑤
卤代烃;⑤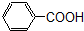 羧酸;
羧酸;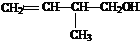
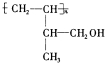 .
. +Cl2→CH2ClCHClCH(CH3)CH2OH.
+Cl2→CH2ClCHClCH(CH3)CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格.(涉及到电极填写具体物质的元素符号)
某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格.(涉及到电极填写具体物质的元素符号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H6O | B. | C5H12 | C. | C5H12O2 | D. | C5H12O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com