
| A. | 1mol/L Na2SO4溶液200mL | B. | 0.9mol/L Na3PO4溶液200mL | ||
| C. | 2.5mol/L NaOH 溶液100mL | D. | 1mol/L NaHCO3溶液300mL |
分析 钠离子的物质的量浓度与溶液体积无关,与溶质的物质的量浓度及溶质的化学式组成有关,据此对各选项进行判断.
解答 解:A.1mol/L Na2SO4溶液200mL,钠离子浓度为1mol/L×2=2mol/L;
B.0.9mol/L Na3PO4溶液200mL,钠离子浓度为:0.9mol/L×3=2.7mol/L;
C.2.5mol/L NaOH 溶液100mL:钠离子浓度为:2.5mol/L;
D.1mol/L的NaHCO3溶液300mL:钠离子浓度为1mol/L;
根据分析可知,钠离子浓度最大的为B,
故选B.
点评 本题考查了物质的量浓度的计算与判断,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意离子浓度与溶液体积无关,为易错点.


科目:高中化学 来源: 题型:解答题
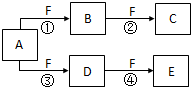 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.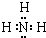 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
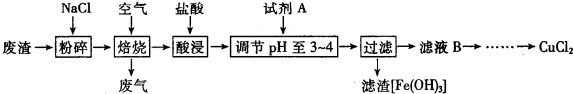
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
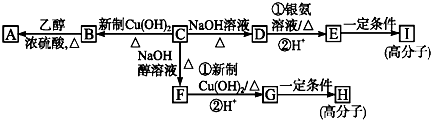
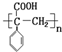 .
.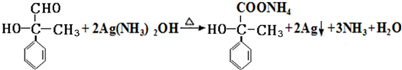 .
.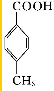 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、SO42- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧生成Na2O | |
| B. | 热稳定性,Na2CO3比NaHCO3强,而水溶性,NaHCO3 比Na2CO3易溶于水 | |
| C. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明该溶液一定存在Na+,不存在K+ | |
| D. | 将Na投入NH4Cl溶液中可生成两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:Y>Z>W>X | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z弱 | |
| C. | 化合物YX、ZX2、WX3中化学键类型相同 | |
| D. | 元素W的简单气态氢化物的热稳定性比X强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
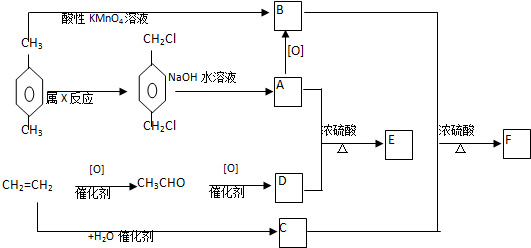
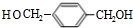 ; CCH3CH2OH.
; CCH3CH2OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com