
【题目】吗氯贝胺是新一代缓和的抗抑郁药物,某研究小组设计如图合成路线:
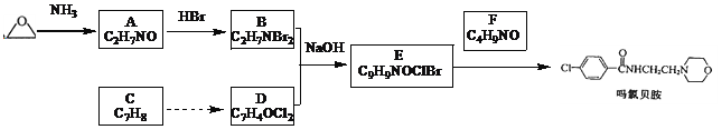
已知:①R-Br![]()
②R-COOH![]() R-COCl
R-COCl![]() R-CONHR′
R-CONHR′
③苯环上连羧基时,苯环上再取代主要生成间位取代产物。
按要求回答下列问题:
(1)化合物![]() 的结构简式________。
的结构简式________。
(2)下列有关说法正确的是________。
A.吗氯贝胺的分子式为![]()
B.在水中溶解能力![]() ,原因是
,原因是![]() 与水分子间可形成氢键
与水分子间可形成氢键
C.![]() 的反应中
的反应中![]() 的作用是反应产生氨基及中和反应产生的酸
的作用是反应产生氨基及中和反应产生的酸
D.![]() 吗氯贝胺的反应类型为取代反应
吗氯贝胺的反应类型为取代反应
(3)写出![]() 的反应方程式________。
的反应方程式________。
(4)![]() 与
与![]() 反应制备吗氯贝胺中加适量碳酸钾或过量
反应制备吗氯贝胺中加适量碳酸钾或过量![]() 均有利于提高产率,用反应方程式解释加过量
均有利于提高产率,用反应方程式解释加过量![]() 有利于提高产率的原因________。
有利于提高产率的原因________。
(5)设计![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
(6)写出化合物![]() 同时符合下列条件的同分异构体的结构简式________。
同时符合下列条件的同分异构体的结构简式________。
①![]() 谱检测表明:分子中有3种氢原子;
谱检测表明:分子中有3种氢原子;
②![]() 谱检测表明:分子中存在
谱检测表明:分子中存在![]() 。
。
【答案】HOCH2CH2NH2 ACD 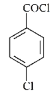 + BrCH2CH2NH3Br+NaOH→
+ BrCH2CH2NH3Br+NaOH→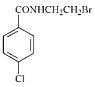 +NaBr+NaCl+H2O
+NaBr+NaCl+H2O ![]() +HBr→
+HBr→![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
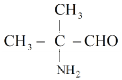 、
、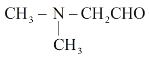 、
、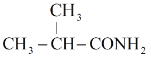
【解析】
根据题给已知①,结合吗氯贝胺的结构及E、F的分子式可知:E为 ,F为
,F为![]() ;根据题给已知②,结合E的结构简式及B、D的分子式可知:B为BrCH2CH2NH3Br,D为
;根据题给已知②,结合E的结构简式及B、D的分子式可知:B为BrCH2CH2NH3Br,D为 ,则A为HOCH2CH2NH2,结合分子式可知C为
,则A为HOCH2CH2NH2,结合分子式可知C为![]() ,据此解答。
,据此解答。
(1)![]() 的结构简式为HOCH2CH2NH2,故答案为:HOCH2CH2NH2;
的结构简式为HOCH2CH2NH2,故答案为:HOCH2CH2NH2;
(2)A.吗氯贝胺的结构简式为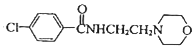 ,分子式为
,分子式为![]() ,A正确;
,A正确;
B.A为HOCH2CH2NH2,B为BrCH2CH2NH3Br,BrCH2CH2NH3Br为有机盐,在水中的溶解度大于A,B错误;
C.![]() 即:
即: +BrCH2CH2NH3Br→
+BrCH2CH2NH3Br→ ,
,![]() 的作用是与BrCH2CH2NH3Br反应释放氨基和-COCl反应、中和反应产生的酸,提高产率,C正确;
的作用是与BrCH2CH2NH3Br反应释放氨基和-COCl反应、中和反应产生的酸,提高产率,C正确;
D.![]() 吗氯贝胺时,E中的-Br被F中的
吗氯贝胺时,E中的-Br被F中的![]() -取代,为取代反应,D正确;
-取代,为取代反应,D正确;
故答案为:ACD;
(3)![]() 的反应方程式为
的反应方程式为 + BrCH2CH2NH3Br+NaOH→
+ BrCH2CH2NH3Br+NaOH→ +NaBr+NaCl+H2O,故答案为:
+NaBr+NaCl+H2O,故答案为: + BrCH2CH2NH3Br+NaOH→
+ BrCH2CH2NH3Br+NaOH→ +NaBr+NaCl+H2O;
+NaBr+NaCl+H2O;
(4)E( )与F(
)与F(![]() )反应生成吗氯贝胺(
)反应生成吗氯贝胺(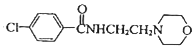 )和HBr,加适量碳酸钾或过量的
)和HBr,加适量碳酸钾或过量的![]() 能和产物HBr反应,使主反应尽可能向右进行,从而提高吗氯贝胺产率,F和HBr反应的方程式为:
能和产物HBr反应,使主反应尽可能向右进行,从而提高吗氯贝胺产率,F和HBr反应的方程式为:![]() +HBr→
+HBr→![]() ,故答案为:
,故答案为:![]() +HBr→
+HBr→![]() ;
;
(5)C为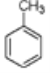 ,D为
,D为 ,C制取D可作如下逆合成
,C制取D可作如下逆合成 可由
可由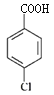 和SOCl2发生类似“已知②”反应而得到,结合已知③,
和SOCl2发生类似“已知②”反应而得到,结合已知③, 可通过
可通过![]() 氧化而得到,
氧化而得到,![]() 由
由![]() 和Cl2反应得到,即流程如下:
和Cl2反应得到,即流程如下:![]()
![]()
![]()
![]()
![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]()
![]()
![]()
![]()
![]() ;
;
(6)F为![]() ,不饱和度为1,它的同分异构体分子中存在
,不饱和度为1,它的同分异构体分子中存在![]() ,则同分异构体结构中除
,则同分异构体结构中除![]() 外,其余结构不含不饱和结构,核磁共振氢谱显示有3种氢原子,符合条件的有如下3种:
外,其余结构不含不饱和结构,核磁共振氢谱显示有3种氢原子,符合条件的有如下3种: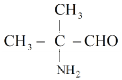 、
、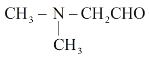 、
、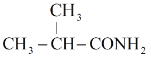 ,故答案为:
,故答案为: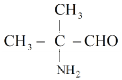 、
、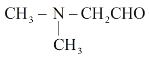 、
、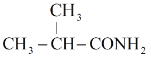 。
。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+ O2 (g)![]() 2SO3 (g);△H=﹣197kJmol﹣1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达到平衡时,下列关系一定正确的是
2SO3 (g);△H=﹣197kJmol﹣1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达到平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙>2P乙
B.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.SO3的质量m:m甲=m丙>2m乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究![]() 溶液与
溶液与![]() 溶液的反应,实验如下:
溶液的反应,实验如下:
实验1 |
|
实验2 |
|
下列分析不正确的是( )
A.白色沉淀![]() 、
、![]() 都是含铝化合物
都是含铝化合物
B.白色沉淀的![]() 与稀硫酸反应时有
与稀硫酸反应时有![]() 气体生成
气体生成
C.白色沉淀![]() 、
、![]() 的成分不同,洗涤时要检验是否洗涤干净必须用不同的试剂
的成分不同,洗涤时要检验是否洗涤干净必须用不同的试剂
D.实验1、2中白色沉淀成分不同可能与混合后溶液的![]() 有关
有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置,用![]() 与
与![]() 反应制取氢化钙
反应制取氢化钙![]() 。下列有关该实验的说法不正确的是( )
。下列有关该实验的说法不正确的是( )
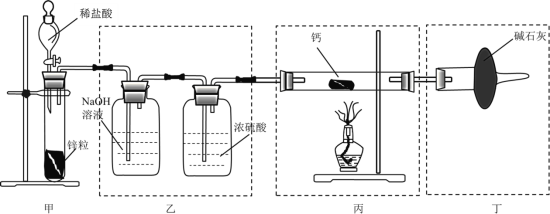
A.甲中若将稀盐酸改为稀硫酸,装置乙中装![]() 溶液的洗气瓶可舍去
溶液的洗气瓶可舍去
B.装置丁中碱石灰的作用是防止外界的水蒸气与二氧化碳进入
C.实验时应先通一段时间氢气,检验尾气纯度后再点燃酒精灯加热
D.取少量反应后固体与水反应,通过观察是否有气体产生来判断产物是否为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据:
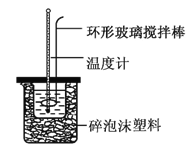
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是__________。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=__[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_______(填“偏大”、“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是_________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知粗盐水中含![]() ,含
,含![]() 。向粗盐水中加入
。向粗盐水中加入![]() 除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入
除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入![]() 除
除![]() 。
。
(1)处理上述粗盐水![]() ,至少需要加
,至少需要加![]() ________
________![]() 。(保留三位有效数字)
。(保留三位有效数字)
(2)如果用碳酸化尾气(含![]() 体积分数为0.100、
体积分数为0.100、![]() 体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2
体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2![]() 。处理上述
。处理上述![]() 粗盐水至少需要通入标准状况下________
粗盐水至少需要通入标准状况下________![]() 碳酸化尾气。(需列式计算,保留三位有效数字)
碳酸化尾气。(需列式计算,保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成份是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:
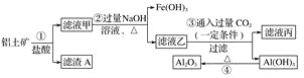
请回答下列问题:
(1)请写主要成份的化学式:滤渣A________,滤液丙中的溶质是NaCl和________。
(2)反应②中Al3+反应的离子方程式为_________________;反应③的离子方程式为____________;反应④的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
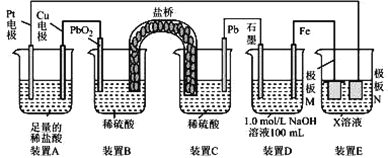
A.盐桥中的阳离子向装置B移动
B.装置A中总反应的离子方程式为 Cu+2H+ ![]() Cu2++H2 ↑
Cu2++H2 ↑
C.若在装置 D 中生成 0. 2 mol Fe(OH)3,则消耗水的物质的量共为0. 5mol
D.若装置E的目的是在Cu材料上镀银,则极板 N 的材料为Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com