
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
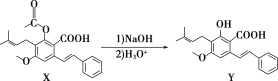
下列有关化合物X、Y的说法正确的是( )
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目不相等
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )。
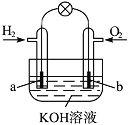
A.氢氧燃料电池是一种具有应用前景的绿色电源
B.a极是负极,该电极上发生氧化反应
C.总反应方程式为2H2+O2=2H2O
D.b极反应是O2+4OH--4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
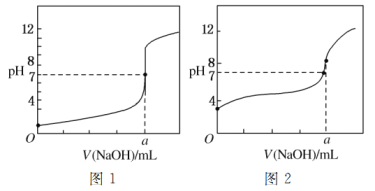
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解有关的正确说法是
①明矾和![]() 可作净水剂
可作净水剂
②实验室配制![]() 溶液时,应先把它溶在盐酸中,而后加水稀释
溶液时,应先把它溶在盐酸中,而后加水稀释
③氯化铝溶液蒸干不能得到固体![]()
④用三氯化铁溶液制备氢氧化铁胶体
⑤实验室盛放![]() 、
、![]() 等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用![]() 与
与![]() 两种溶液可作泡沫灭火剂
两种溶液可作泡沫灭火剂
⑦在![]() 或
或![]() 溶液中加入金属镁会产生氢气
溶液中加入金属镁会产生氢气
⑧长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
⑨比较![]() 和
和![]() 等溶液中离子浓度的大小或某些盐溶液的酸碱性
等溶液中离子浓度的大小或某些盐溶液的酸碱性
⑩![]() 与
与![]() 溶液可作焊接中的除锈剂
溶液可作焊接中的除锈剂
A.①④⑦B.②⑤⑧C.③⑥⑨D.全有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+Fe2(SO4)3=3FeSO4的能量变化趋势如图所示:

(1)该反应为_____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.升高温度 C.减小压强 D.加入适量的Na2SO4固体
(3)若将上述反应设计成原电池,且铜为此原电池的某一电极材料,则铜为____(填“正”或“负”)极。Fe电极上发生的电极反应为_____,溶液中的阳离子向______(填“正”或“负”)极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1的盐酸和25.00 mL 0.1 mol·L-1氨水混合。
(1)当加入10.00 mL稀盐酸时,溶液中的溶质是________(填化学式),溶液的pH______(填“>”、“<”或“=”)7。
(2)当某一时刻溶液中c(NH4+)=c(Cl-),此时溶液的pH____(填“>”、“<”或“=”)7。所加的盐酸体积V ____(填“>”、“<”或“=”)25.00 mL。其原因是_______。
(3)某一时刻溶液中会不会存在:c(Cl-)>c(NH4+),且c(OH-)>c(H+)的关系?_____(填“会”或“不会”)。其原因是________。
(4)已知常温时 ,K(NH3·H2O)=1.8×10-5 当V(HCl)=12.50 mL时,下列离子浓度的大小关系是: c(Cl-) ___ c(NH4+) ,c(OH-) ___ c(H+)。(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的冶炼中,正确的是:
A.以海水为原料制得精盐,再电解精盐的水溶液制取钠
B.用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C.以铁矿石、焦炭、空气等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D.用铝热法还原MnO2和Cr2O3,制得金属各1mol,消耗铝较少的是MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.葡萄糖分子(HOCH2-CHOH-CHOH-CHOH-CHOH–CHO)中的手性碳原子数为4
B.氯化铯晶体中氯离子的配位数为8
C.![]() 的中心离子配位数为6
的中心离子配位数为6
D.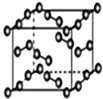 碘晶体中碘分子的排列方向种数为4
碘晶体中碘分子的排列方向种数为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,![]() 废气的处理已成为研究的热点,图1是以
废气的处理已成为研究的热点,图1是以![]() 为主要原料的化工产品的生产过程。
为主要原料的化工产品的生产过程。

(1)关于侯氏制碱法,回答下列问题:
①写出![]() 的电子式______。
的电子式______。
②实验室制取![]() 的化学方程式______。
的化学方程式______。
③由侯氏制碱法获得![]() 分为两步:
分为两步:
I.![]()
II.______。
(2)尿素是重要的氮肥,请写出由![]() 生产尿素的化学方程式______。
生产尿素的化学方程式______。
(3)![]() 催化加氢制取汽油过程中发生如下反应:
催化加氢制取汽油过程中发生如下反应:
![]()
![]()
![]()
![]()
已知:在一定温度下,10L的密闭容器中,通入![]()
![]() 和
和![]()
![]() ,反应过程如图2所示,回答下列问题:
,反应过程如图2所示,回答下列问题:
①计算该温度下反应的平衡常数![]() ______。
______。
②下列可以判断该反应达到平衡状态的是______。
![]() 单位时间内,
单位时间内,![]() 的减少量等于CO的生成量
的减少量等于CO的生成量
![]() 反应容器内的压强不发生变化
反应容器内的压强不发生变化
![]() 混合气体中
混合气体中![]() 的浓度不再发生改变
的浓度不再发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com