
����Ŀ����1���ٱ�״���£�1g������14g�����������ͬ
�ڳ��³�ѹ�£�16g�����ͳ����Ļ�������к��е�������Ϊ8NA
��0.1L 0.5mol/LCH3CH2OH��Һ�к�����ԭ����Ϊ0.3NA
�ܳ��³�ѹ�£�28gCO���������22.4L
�ݷ���������ȵ�NO2��CO2��������ԭ������Ϊ2NA
������������ȷ���У�_______
��2��������ƿ������Һʱ�����ڲ����������������
������ƽ����ʱ������������
������Ͳ��ȡ����Ũ��Һʱ�����ӿ̶�
����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ��
��ת����Һǰ����ƿ������������ˮ
�ݶ���ʱ����������ƿ�Ŀ̶���
���ݺ�ҡ�ȣ�����Һ�潵�ͣ��ֲ�������ˮ�����´ﵽ�̶���
���������ʹ������ҺŨ��ƫ�͵��� ��_______
���𰸡��٢ڢ� �ۢ�
��������
������״���£�1g�������ʵ���![]() ��14g���������ʵ���
��14g���������ʵ���![]() ��ͬ��ͬѹ�����֮�ȵ������ʵ���֮�ȣ���������ͬ��������ȷ��
��ͬ��ͬѹ�����֮�ȵ������ʵ���֮�ȣ���������ͬ��������ȷ��
�����³�ѹ�£�16g�������ʵ���![]() ��һ����������������16����0.5 mol��������������Ϊ0.5mol �� 2 �� NA mol-1 =8NA��16g�������ʵ���
��һ����������������16����0.5 mol��������������Ϊ0.5mol �� 2 �� NA mol-1 =8NA��16g�������ʵ���![]() ��һ����������24����������
��һ����������24����������![]() ��������������Ϊ
��������������Ϊ![]() ��3��NA mol-1 = 8NA�����16g��������к��е�������Ϊ8NA��������ȷ��
��3��NA mol-1 = 8NA�����16g��������к��е�������Ϊ8NA��������ȷ��
��0.1L 0.5mol/LCH3CH2OH���ʵ���![]() ��������ԭ����0.05mol �� 6 �� NA mol-1 =0.3NA����������Һ����ˮ��ˮ�к�����ԭ�ӣ���˺�����ԭ����Ϊ����0.3NA����������
��������ԭ����0.05mol �� 6 �� NA mol-1 =0.3NA����������Һ����ˮ��ˮ�к�����ԭ�ӣ���˺�����ԭ����Ϊ����0.3NA����������
�����³�ѹ�£�28gCO�����ʵ���![]() �����³�ѹ�£�����Ħ���������22.4Lmol-1����˳��³�ѹ��28gCO���������22.4L��������ȷ��
�����³�ѹ�£�����Ħ���������22.4Lmol-1����˳��³�ѹ��28gCO���������22.4L��������ȷ��
������������ȵ�NO2��CO2��ÿ�����Ӷ�����2��ԭ�ӣ������ʵ��������������˵������ԭ������Ϊ2NA��ֻ��˵������ԭ������ȣ�������������������������ȷ���У��٢ڢ����ʴ�Ϊ�٢ڢ���
��������ƽ����ʱ�����������⣬�����������ӣ����������������ӣ���������ҺŨ��ƫ�ߣ���������������⣻
������Ͳ��ȡ����Ũ��Һʱ�����ӿ̶ȣ�����Ũ��Һ���ƫ�����ƺ���Һ���ƫ�ߣ��������������⣻
����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ�ӣ���Һ���������ˣ����ƫ�ͣ������������⣻
��ת����Һǰ����ƿ������������ˮ����ˮʱ���涨��ʱ�ټ�ˮ���ɣ���˲�Ӱ�죬�������������⣻
������ʱ����������ƿ�Ŀ̶��ߣ���Һ�����ƫС�����ƫ�ߣ��������������⣻
�����ݺ�ҡ�ȣ�����Һ�潵�ͣ��ֲ�������ˮ�����´ﵽ�̶��ߣ���Һ�����ƫ�����ƫ�ͣ������������⣻��˻�ʹ������ҺŨ��ƫ�͵����ۢ����ʴ�Ϊ�ۢ���


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(AlP)��һ�ֳ�������ʳ�ִ��Ĺ�����Ѭ��ɱ�������ˮ���������߶������� PH3(�е㣭89.7������ԭ��ǿ)����������ί�涨��ʳ������(��PH3��)�IJ�����������0.0500 mg/kgʱΪ�����ϸ�֮���ϸ�ij��ѧ��ȤС���ͬѧ�����������ⶨij��ʳ��Ʒ �в���������������ж��Ƿ�ϸ�
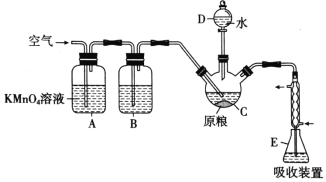
��C�м���100gԭ����E�м���20.00 mL 2.50��10-4 mol/ L KMnO4��Һ(H2SO4�ữ)����C�м�������ˮ����ַ�Ӧ�����������Ʊ���Һ�ζ�E�й�����KMnO4��Һ���ش��������⣺
(1)PH3�ĵ���ʽΪ___________������C��������___________��
(2)A�����Ը��������Һ��������___________ͨ�������������______________________��
(3)PH3Ҳ�ɱ�NaClO�����������Ʊ�NaH2PO2���Ƶõ�NaH2PO2��NiCl2��Һ�����ڻ�ѧ������ ͬʱ����������Ȼ����д����ѧ�����Ļ�ѧ����ʽΪ______________________________��
(4)װ��E��PH3�����������ᣬ��ַ�Ӧ�������Һ����ˮϡ����250mL��ȡ25.00mL����ƿ�У���4.0��10��5mol/L��Na2SO3����Һ�ζ�ʣ���KMnO4��Һ������Na2SO3����Һ 20.00mL��Na2SO3��KMnO4��Һ��Ӧ�����ӷ���ʽΪ��SO32��+MnO4��+H+��SO42��+Mn2++H2O(δ��ƽ)����ζ��յ������Ϊ______________________________________________��
��ԭ����Ʒ������(��PH3��)�IJ�����Ϊ__________________mg/kg����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ���������ȡ���仯�ɱ���Ϊ��KClO3��HCl(Ũ)== KCl��ClO2����Cl2������
(1)�� д�������Ļ�ѧ����ʽ����ƽ_______��
(2)Ũ�����ڷ�Ӧ����ʾ������������_______(��д���)��
��ֻ�л�ԭ�� ����ԭ�Ժ����� ��ֻ�������� �������Ժ�����
(3)��˫���ŷ���������ת�Ƶķ������Ŀ____��
(4)����0.1molCl2����ת�Ƶĵ��ӵ����ʵ���Ϊ___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������NaOH��������1.0 mol��L-1��NaOH��Һ240 mL��������������ȷ���ǣ� ��

A.ijͬѧ������һ������NaOH���壬������������ƽ�����ձ�����������ƽƽ����״̬��ͼ�����ձ���ʵ������Ϊ27.4 g
B.Ҫ��ɱ�ʵ���ͬѧӦ�Ƴ�10.0g NaOH
C.�������ƹ����ܽ�����ָ��������ٽ���ת��
D.����ƿʹ��ǰ��ϴ�ӡ������ָ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¶���ڿ����е�ij�������ƹ�����Ʒ����ˮ����������Һ����μ���ϡ���������������ɵ�CO2(��״��)������������������ͼ��ʾ�Ĺ�ϵ(������CO2��ˮ�е��ܽ�)������˵������ȷ����(����)
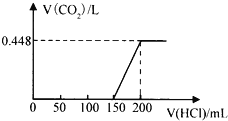
A. �μ�����0��150mL�η����ķ�Ӧ����ΪOH��+H+��H2O��CO32��+H����HCO3��
B. ������������ʵ���Ũ��Ϊ0.4 molL��1
C. CO2������ٸı�ʱ����Һ�е�����ΪNaCl
D. ����Ʒ��NaOH��Na2CO3���ʵ���֮��Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ƶõĵ�����(AlN)��Ʒ�г���������Al4C3��Al2O3��C�����ʡ�ijͬѧ�������ʵ��ֱ�ⶨ������(AlN��Ʒ��AlN��Al4C3����������(����NH3��ǿ������Һ�е��ܽ�)��
��1��ʵ��ԭ������Al4C3�����ᷴӦ������CH4��
��AlN����ǿ�������Σ�����ǿ�����ɰ�������д��AlN��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________��
��2��ʵ��װ��(��ͼ��ʾ��������Ϊ��ʽ�ζ��ܸ�װ)
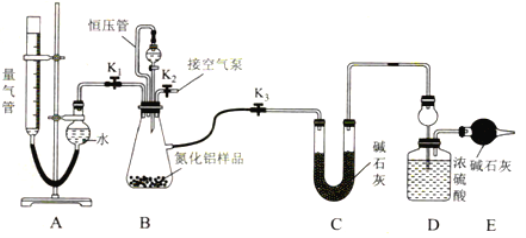
����װ�ú�����Ӧ���еIJ�����________��
��3��ʵ����̣��Ƶ�װ��D�ij�ʼ����Ϊy g����ȡx g AlN��Ʒ����װ��B��ƿ�У���װ���м�����ӦҩƷ����������װ�ã���ȡ�����ܵij�ʼ����Ϊa mL(����װ������Һ����ƽ)��
�������Ȳ���Al4C3�����������й����ݣ������������IJ�����________��
������ѹ�ܣ����������������Ӱ����________(�ƫ��ƫС������Ӱ�족)
����������Һ�治�ٷ����仯��˵����Ӧ�Ѿ���������ȡ����֮ǰ��Ӧ�������ܽ��е��������ܸ߶ȣ�ʹ��������Һ����ƽ �����������е�Һ������Ҳ����������е�Һ�棬������������______(�ƫ��ƫС������Ӱ�족)��
�ܼ�¼�ζ��ܵĶ���Ϊb mL(��֪����ʵ�������µ�����Ħ�����ΪVm L��mol��1)����Al4C3����������Ϊ______(�ú�a��b��x��y��Vm�Ĵ���ʽ��ʾ)��
�ݲ���AlN�������������ݣ����ȹرջ��� K1 ������K3��ͨ����Һ©���������___����װ��Bƿ�����ʳ�ַ�Ӧ����Ӧ��ɺ�____(����ò�Ӧ���еIJ���)�����Ƶ�װ��D������Ϊz g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 56g����ϩ�����к�̼̼˫������ĿΪ2 NA
B. 2 mol NH3��3molO2�ڴ����ͼ��������³�ַ�Ӧ����NO�ķ�����Ϊ2 NA
C. Ǧ���طŵ�ʱ����������������������������16gʱת�Ƶ�����ΪNA
D. 1L0.5 mol/L Al2Fe(SO4)4��Һ����������ĿС��1.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Լ�������ͽ��۾���ȷ����
ѡ�� | ʵ��װ�� | ���� | ���� |
A |
| װ�â�����dz��ɫ���� | ����Ũ��ˮ����ȡ����Ӧ |
B |
| ���������Һ��ɫ��������Ȼ�̼��Һ��ɫ | ʯ���͵ķֽ�����к��в������� |
C |
| ʢ�б���̼������Һ���Թ��У��Ϸ�������״Һ�� | �Ʊ��������� |
D |
| ���������� | �����Ҵ������(CH3OCH3) |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴Ӧ��4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g) ��H����1 025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����( )
4NO(g)��6H2O(g) ��H����1 025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����( )
A. 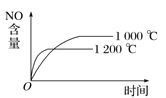 B.
B. 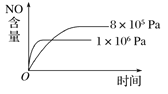
C. 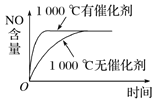 D.
D. 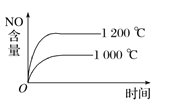
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com