
| A、溶液中始终有:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-) |
| B、t溶液呈中性时:c(Na+)═c(HS-)+c(S2-) |
| C、等体积混合后溶液中一定有:c(H2S)+c(H+)═c(S2-)+c(OH-) |
| D、恰好完全中和后的溶液中:c(Na+)>2c(S2-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应混合物中各组分的浓度相等 |
| B、正逆反应都还在继续进行 |
| C、正逆反应的速率均为零 |
| D、化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若混合后溶液pH=7,则c(NH4+)═c(Cl-) |
| B、若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、若a=2b,则(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、若混合后溶液满足c(H+)═c(OH-)+c(NH3?H2O),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:
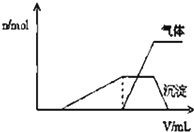 1L某混合溶液中可能含有的离子如下表:
1L某混合溶液中可能含有的离子如下表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ |
| 可能大量含有的阴离子 | Cl-Br-I?ClO?AlO2- |
| Cl2的体积 (标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃、101kPa下:2NaHCO3(s)═Na2CO3(s)+H2O(l)+CO2(g)△H=(2b-a) kJ/mol |
| B、相同温度下,同物质的量浓度的碳酸钠和碳酸氢钠溶液中的离子种类相同 |
| C、相同温度、压强条件下,向等体积等物质的量浓度的碳酸钠和碳酸氢钠中加入足量的盐酸,产生的二氧化碳不相等 |
| D、碳酸钠固体和碳酸氢钠固体中阴阳离子个数比相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com