

分析 实验室利用硫酸亚铁制取聚铁,在硫酸亚铁溶液中加入浓硫酸调节PH值,用双氧水将亚铁离子氧化成铁离子,利用铁离子水解,再与硫酸根结合生成聚铁,进而得到固态聚铁,
(1)双氧水具有强氧化性,能够将亚铁离子氧化成铁离子,据此写出反应的离子方程式;
(2)根据亚铁离子在溶液中易水解,所以加酸可以抑制亚铁离子的水解,同时酸性条件下双氧水的氧化性增强;
(3)由FeSO4生成聚合硫酸铁[Fe2(OH)n(SO4)(3-0.5n)]m,反应物为:FeSO4、H2O2、H2SO4,生成物为:[Fe2(OH)n(SO4)(3-0.5n)]m,亚铁离子化合价从+2升高1价变为+3价铁离子,由于产物[Fe2(OH)n(SO4)(3-0.5n)]m中含有m个铁离子,则化合价至少升高m价,双氧水中O元素从-1价较低为-2价,化合价降低1价,双氧水中含有2个O原子,至少降低2价,所以化合价变化的最小公倍数为2m,硫酸亚铁的系数为2,双氧水的系数为m,然后根据质量守恒定律配平反应的方程式;
(4)①根据题意,过量的SnCl2和Fe3+反应生成 Fe2+和SnCl62-,根据电子得失守恒和元素守恒可书写反应的离子方程式;
②根据Sn2+能够还原Cr2O72-而造成较大的实验误差进行判断;
③根据关系式6Fe2+~Cr2O72-计算出亚铁离子物质的量,进而计算聚铁中铁的质量分数.
解答 解:(1)硫酸亚铁溶液中加入双氧水后,亚铁离子被双氧水氧化成铁离子,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(2)根据制取流程可知,下一步需要加入双氧水氧化亚铁离子,双氧水在酸性条件下氧化性增强,所以加入浓硫酸后可以提高双氧水的氧化能力;亚铁离子在溶液中容易发生水解,加入浓硫酸增大溶液中氢离子,可以抑制Fe2+水解,
故答案为:抑制Fe2+水解;提高H2O2的氧化能力(或促进Fe2+被氧化);
(3)由FeSO4生成聚合硫酸铁[Fe2(OH)n(SO4)(3-0.5n)]m,反应物为:FeSO4、H2O2、H2SO4,生成物为:[Fe2(OH)n(SO4)(3-0.5n)]m,亚铁离子化合价从+2升高1价变为+3价铁离子,由于产物[Fe2(OH)n(SO4)(3-0.5n)]m中含有m个铁离子,则化合价至少升高m价,双氧水中O元素从-1价较低为-2价,化合价降低1价,双氧水中含有2个O原子,至少降低2价,所以化合价变化的最小公倍数为2m,硫酸亚铁的系数为2,双氧水的系数为m,然后根据质量守恒定律配平,配平后的方程式为:2mFeSO4+mH2O2+(1-0.5n)mH2SO4=[Fe2(OH)n(SO4)(3-0.5n)]m+(2-n)mH2O,
故答案为:2mFeSO4+mH2O2+(1-0.5n)mH2SO4=[Fe2(OH)n(SO4)(3-0.5n)]m+(2-n)mH2O;
(4)①过量的SnCl2和Fe3+反应生成Fe2+和SnCl62-,铁离子化合价从+3变为+2,化合价降低1价;SnCl2中Sn元素化合价从+2变为SnCl62-中的+4,化合价升高2价,则化合价变化的最小公倍数为2,所以铁离子的系数为2,Sn2+的系数为1,配平后的反应方程式为:Sn2++2Fe3++6Cl-=2Fe2++SnCl62-,
故答案为:Sn2++2Fe3++6Cl-=2Fe2++SnCl62-;
②Sn2+能够被Cr2O72-氧化,所以为防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差,需要用HgCl2除去过量的SnCl2,
故答案为:防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差;
③氧化还原反应中化合价升降相等,亚铁被氧化成铁离子,转移1个电子,Cr2O72-被还原为Cr3+,转移6个电子,根据电子守恒可得:
6Fe2+~Cr2O72-,
6mol 1mol
n 0.1000mol/L×0.0128L
则:n=$\frac{6mol×0.1000mol/L×0.0128L}{1mol}$=0.00768mol,
故聚铁中铁的质量分数为:$\frac{0.00768mol×\frac{100mL}{20mL}×56g/mol}{10.00g}$×100%=21.5%,
故答案为:21.5.
点评 本题考查了物质制备实验方案的设计,题目难度中等,涉及了元素质量分数的计算、氧化还原反应的配平等知识,试题综合性较强,充分考查了的学生的分析、理解能力及化学计算能力,是一道质量较高的题目.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 联碱法对母液的处理方法是向母液中通入二氧化碳,冰冻和加食盐 | |
| B. | 列管式热交换器的使用实现了原料的充分利用 | |
| C. | 焙烧辰砂制取汞的反应原理为:HgS+O2$\stackrel{焙烧}{→}$Hg+SO2 | |
| D. | 氯碱工业、铝的冶炼、牺牲阳极的阴极保护法都是应用了电解池的原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
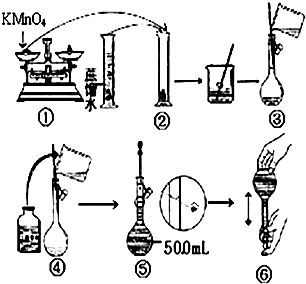 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
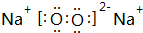 (用电子式表示)
(用电子式表示)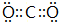 (用电子式表示)
(用电子式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
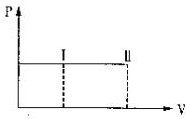 一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.
一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.| A. | 是放热反应 | |
| B. | 反应后气体总分子数增多 | |
| C. | 是吸热反应 | |
| D. | 反应物具有的总能量等于生成物具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH,溶液pH升高,c(SO32-)增大 | B. | 氯化钡有两性 | ||
| C. | 两支试管中的白色沉淀都是BaSO4 | D. | SO2具有两性且水溶液有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com