
| ||
| ||
| ||
| Wg |
| 70a |
| w |
| 70a |
| w |


科目:高中化学 来源: 题型:
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
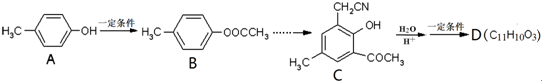
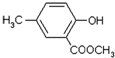 ,合成路线流程图为:
,合成路线流程图为: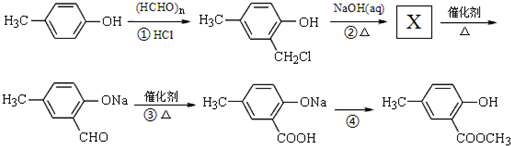
 的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次数 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量(g) | 25 | 25 | 25 | 25 |
| 生成沉淀的质量(g) | 2.9 | X | 8.7 | 8.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
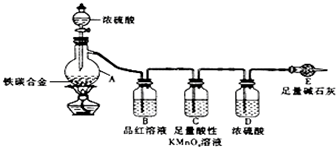
 工业生产的纯碱中常含有少量的NaCl等杂质.如图是测定产品中Na2CO3质量分数的实验装置.(碱石灰是一种既能吸收CO2,又能吸收H2O的物质)
工业生产的纯碱中常含有少量的NaCl等杂质.如图是测定产品中Na2CO3质量分数的实验装置.(碱石灰是一种既能吸收CO2,又能吸收H2O的物质)查看答案和解析>>
科目:高中化学 来源: 题型:
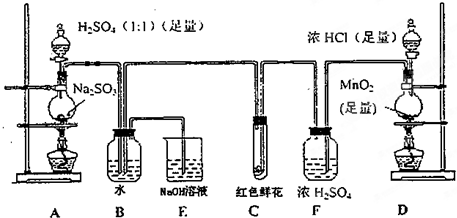
查看答案和解析>>
科目:高中化学 来源: 题型:

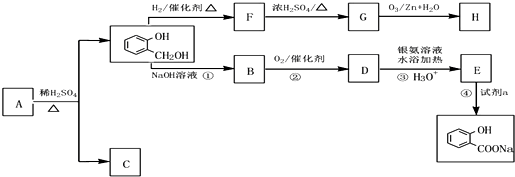
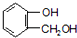 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验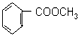 的最佳路线流程图(无机试剂任选).
的最佳路线流程图(无机试剂任选).| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
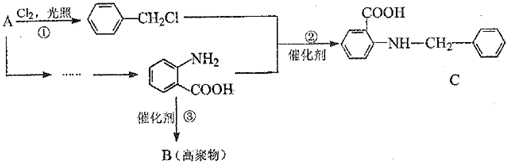
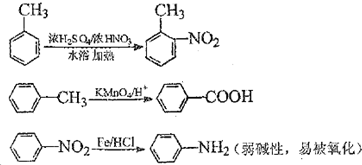
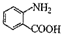 中官能团的名称
中官能团的名称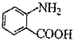 分子与一个α-氨基丙酸分子反应能生成的有机物的结构简式是
分子与一个α-氨基丙酸分子反应能生成的有机物的结构简式是 的同分异构体的结构简式
的同分异构体的结构简式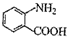 的合成路线.(提示:①合成过程中无机试剂任选;②合成路线表示方法示例如图:C2H5OH
的合成路线.(提示:①合成过程中无机试剂任选;②合成路线表示方法示例如图:C2H5OH| 浓硫酸 |
| 170℃ |
| Br2 |
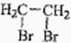 )
)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用经甲醛处理过的胶合板装修居室 |
| B、用甲醛处理过的衬衫具有免熨效果 |
| C、将生物标本浸于盛有甲醛水溶液的密封瓶中 |
| D、海产品用甲醛水溶液浸泡,以保鲜防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com