
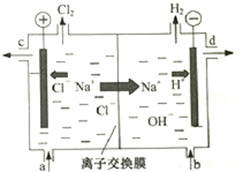
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.| K1 | K2 | |
| H2SO3 | 1.54x 10-2 | 1.02x 10-7 |
| HClO | 2.95x 10-8 | |
| H2CO3 | 4.3x 10-7 | 5.6x 10-11 |
分析 (1)电解精制饱和食盐水生成氯气、氢气、烧碱;
(2)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极,精制饱和食盐水从阳极进入;
(3)KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,发生氧化还原反应,结合质量守恒可书写化学方程式;
(4)H2SO3Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-;
H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11.说明SO32-水解程度小于CO32-.
解答 解:(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;
Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,
故答案为:a;d;
(3)KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,反应的方程式为:2KClO3+H2C2O4+2H2SO4═2ClO2↑+2CO2↑+2KHSO4+2H2O,
故答案为:2KClO3+H2C2O4+2H2SO4═2ClO2+2CO2↑+2KHSO4+2H2O;
(4)H2SO3 Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-,0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH,依据电离平衡常数大小比较,H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11.说明SO32-水解程度小于CO32-,浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)c(HCO3-)>c(HSO3-),
故答案为:>;c(SO32-)>c(CO32-)c(HCO3-)>c(HSO3-).
点评 本题考查了电解原理的分析,电极分析判断方法,化学方程式书写,主要是弱电解质电离程度大小和盐类水解的原理应用,离子浓度大小比较,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.2 mol/L的NaCl溶液 | B. | 100 mL 0.1 mol/L的NaCl溶液 | ||
| C. | 25 mL 0.2 mol/L的Na2SO4溶液 | D. | 50 mL 0.1 mol/L的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加快反应速率的过程是炼钢 | |
| B. | 世界上第一张元素周期表的作者是门捷列夫 | |
| C. | 乙烯与溴的四氯化碳溶液反应的类型为取代反应 | |
| D. | 在葡萄糖溶液中加入新制的Cu(OH)2,加热煮沸后产生沉淀的颜色为砖红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | p1>p2,n>3 | B. | p1>p2,n<3 | C. | p1<p2,n>3 | D. | p1<p2,n<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加盐酸时,c (Na+)+c(OH-)=c(NH3•H2O) | |
| B. | 加入10mL盐酸时,c(NH4+)+c(H+)=c(OH-) | |
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c (Na+) | |
| D. | 加入20mL盐酸时,c(Cl-)=c(NH4+)+c (Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
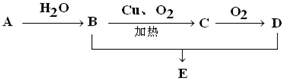 如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.
如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单晶硅常用于制光导纤维 | |
| B. | 可用醋酸除去水瓶中的水垢 | |
| C. | 开发氢能源汽车,可减少PM2.5的排放 | |
| D. | 工业合成氨属于人工固氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg的金属性比Al强 | B. | H-的离子半径大于Li+ | ||
| C. | HCl的热稳定性比HF强 | D. | HClO4的酸性比H3PO4强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com