
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
【知识点】物质的量浓度 常见金属的性质A3 C1 C2
【答案解析】(1)1:2:3 (2)6:3:2 (3)6:3:2 (4)3:2
解析:(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,氯离子的物质的量之比是1:2:3,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为1:2:3。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,就是求氯离子的物质的量浓度相等时三种溶液的物质的量浓度之比,即1:1/2:1/3=6:3:2。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,问消耗Na、Mg、Al的物质的量之比,就是求转移等量电子时消耗Na、Mg、Al的物质的量之比,即1:1/2:1/3=6:3:2。
(4)反应分别为2Al+3H2SO4=Al2(SO4)3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为3:2。
【思路点拨】本题考查了物质的量浓度的理解以及金属的性质,理解氧化还原反应规律、顺利书写方程式是关键。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2硝基萘,则化合物(Ⅲ)的名称应是( )
 A.2,6二甲基萘 B.1,4二甲基萘
A.2,6二甲基萘 B.1,4二甲基萘
C.4,7二甲基萘 D.1,6二甲基萘
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
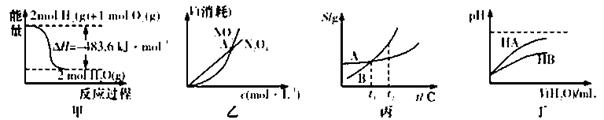
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.下列有关说法不正确的是________。
A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定
B.NH3和H3O+是等电子体,因此结构都是三角锥形
C.邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在
分子间氢键
D.H3O+、HF2-和[Ag(NH3)2]+中均存在配位键
Ⅱ.碳及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为 。第四周期与其有相同
未成对电子数的过渡金属有 (填元素符号)
(2)第一电离能:C、N、O、F四种元素由大到小顺序___ _ ,
原因是 ,
HCN、NF3分子构型分别是 。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子中心间的最短距离为
d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为原子序数依次增大的短周期元素,其中只有一种是金属元素。A、D元素原子最外层电子数相同,且A和D可形成离子化合物,C2 - 和D+ 具有相同的电子数,E元素的最高正化合价与最低负化合价之和为2。由这些元素组成的物质,其组成和结构信息如下表:

请用化学用语回答下列问题:
(1) D+ 的结构示意图为 ;
(2) C、D、E的氢化物按熔点由高到低排列的顺序为 ;
(3) 乙属于 分子(填“极性”或“非极性”),丁的电子式为 ,
(4) 将少量甲投入到AlCl3溶液中反应的离子方程式为 ;
(5) 丙属于 晶体,丙中每个原子均形成4个共价键,其中有一个配位键,提供空轨道的是 ;
氮化硼晶体的熔点要比丙晶体高,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中 ②过量NaOH溶液和明矾溶液馄合 ③少量Ca (OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:
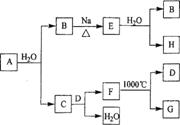
请回答下列问题:
(1)A与水反应的化学方程式为____________,E与水反应的化学方程式为___________;
(2)F的化学式为_____________,G和D的电子式分别为____________和______________;
(3)D与H反应可能生成的盐有_______________ (填化学式);
(4)如何由F制备A : 。
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列关于金属钠的叙述错误的是
A.金属钠可以保存在煤油中
B.金属钠着火时,可用泡沫灭火器来灭火
C.钠与熔融的四氯化钛反应可制取钛
D.实验时用剩的钠块应该放回原试剂瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
已知碳碳单键可以绕键轴自由旋转,结构简式为如下所示的烃,下列说法中正确的是( )
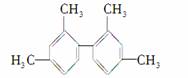
A.分子中至少有9个碳原子处于同一平面内
B.分子中至少有10个碳原子处于同一平面内
C.分子中至少有11个碳原子处于同一平面内
D.该烃属于苯的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com