
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
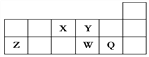
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素X与元素Z的最高正化合价之和的数值等于8
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ
CO(g)+H2O(g) △H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ
(1)一定条件下,将n(CO2): n(H2)=1:1的混合气体充入绝热恒容密闭容器中发生反应。下列事实可以说明反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)已达到平衡的是_______
CH3OH(g)+H2O(g)已达到平衡的是_______
A 容器内气体密度保持不变 B CO2体积分数保持不变
C 该反应的平衡常数保持不变 D 混合气体的平均相对分子质量不变
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应的电极反应式是___________________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的物质的量
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。

(1)写出基态Mn原子的价电子排布图_______。
(2)CoTiO3晶体结构模型如图1。在CoTiO3晶体中与1个Ti原子、1个Co原子周围距离最近的O数目分别为_______个、_______个。
(3) 三聚氰胺(C3N6H6)是一种含氮化合物,其结构简式如图2所示。三聚氰胺分子中氮原子轨道杂化类型是____,1 mol三聚氰胺分子中σ键的数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金与铁的物理性质的比较如下表所示:
熔点/℃ | 密度/ g·cm-3 | 硬度(金刚石为10) | 导电性(银为100) | ||
某合金 | 2 500 | 3.00 | 7.4 | 2.3 | |
铁 | 1 535 | 7.86 | 4.5 | 17 | |
还知该合金耐腐蚀,强度大,从以上性能看,该合金不适合作( )
A. 导线 B. 门窗框 C. 炉具 D. 飞机外壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物界与非生物界具有统一性的一面,是因为( )
A. 构成细胞的化合物在非生物界都存在
B. 构成细胞的有机物在非生物界都存在
C. 构成细胞的化学元素在无机界都能找到
D. 生物界和非生物界都具有代谢活动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是过氧化氢(H2O2)分子和O3分子的空间结构示意图。请回答:


(1) O3分子中非极性共价键是__________键,特殊的化学键是________键。
(2)臭氧与氧气的关系是________。
(3)下列物质的分子与O3分子的结构最相似的是________。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)分子中某一原子有一对没有跟其他原子共用的电子对叫孤电子对。那么,O3分子中有________对孤电子对。
(5)下列关于过氧化氢的说法中正确的是________(用序号填空)。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是pp σ键 ⑤分子是非极性分子
(6)过氧化氢易溶于水,主要原因是_______________________________。
(7)指出下列原子的杂化轨道类型及分子的空间构型。
①SiF4中的Si____杂化,空间构型____;②NO![]() 中的N___杂化,空间构型___。
中的N___杂化,空间构型___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.滴定前用待测液润洗锥形瓶
B.容量瓶和滴定管使用前均需要检漏
C.蒸馏完毕时,先关闭冷凝水,再停止加热
D.分液时,下层溶液先从下口放出,上层溶液再从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为:![]() ,下列说法正确的是
,下列说法正确的是
A. 苹果酸能被氧化成三元羧酸
B. l mol苹果酸可与3 mol NaOH发生中和反应
C. 含1 mol苹果酸的稀溶液与足量金属Na反应生成1.5molH2
D. 2分子苹果酸相互反应,可形成结构为六元环、七元环或八元环的酯类物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com