
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途具有对应关系的是( )
A. 氨气具有还原性,可用作制冷剂 B. 氢氟酸具有弱酸性,可用于蚀刻玻璃
C. 浓硫酸具有脱水性,可用于干燥CO2 D. 二氧化氯具有强氧化性,可用来漂白织物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:填空题
四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
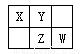
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组化合物中,化学键的类型完全相同的是
①CaCl2 和Na2S ②Na2O 和 Na2O2 ③CO2和 CS2 ④HCl 和 NaOH
A.①② B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:填空题
CO2是温室气体,研究CO2的应用对促进低碳生活具有重要意义。
(1)1922年德国工业化生产尿素
Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
Ⅱ:NH3COONH4(s)  CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
①写出用NH3和CO2合成尿素总反应的热化学方程式_________;按照酸碱质子理论,能接受H+的物质为碱,现常温下溶液中存在反应:NH3+NH2COOH NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
②在一个体积恒为1L的恒温密闭容器中充入2molCO2和4molNH3的混合气体,经历反应Ⅰ、Ⅱ合成CO(NH2)2,混合气体中的氨气体积分数及气体总浓度随时间变化如下图所示。

对于反应Ⅰ:A点的正反应速率与B点的逆反应速率的大小关系是:v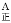 _______v
_______v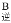 (填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
(填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能_______(“增大”“减小”或“不变”)
(2)利用二氧化碳制备乙烯
用惰性电极电解强酸性二氧化碳水溶液可得到乙烯,其原理如下图所示。
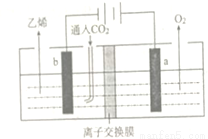
①b电极上的电极反应式为______________;
②该装置中使用的是___________(填“阴” 或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:推断题
下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。

(1)写出B的化学式:______________C的化学式:____________________。
(2)写出D与I溶液发生反应的离子方程式:_________________。
(3)写出L→M的现象是:________________________。
(4)从G与J反应后的混合物中得到M的操作方法叫做___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:简答题
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=_____kJ·mol-1。
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______。
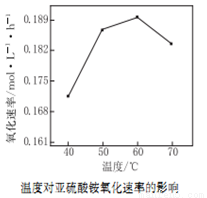
⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=____。 [已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6 ]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________。

②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省、惠安一中、泉州实验中学高一上学期期末联考化学试卷(解析版) 题型:选择题
下列离子方程式中书写正确的是( )
A. 向FeCl2溶液中通入Cl2:Fe2+ + Cl2 = Fe3+ + 2Cl―
B. Ba(OH)2溶液与硫酸的反应:OH―+ H+ = H2O
C. 碳酸氢钠溶液与稀盐酸混合:HCO3―+ H+ = H2O+CO2↑
D. AlCl3溶液中加入过量氨水:Al3+ + 4OH― = AlO2― + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com