
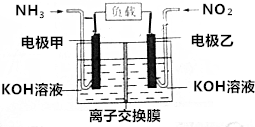
 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )| A. | 电极乙为电池负极 | |
| B. | 离子交换膜为质子交换膜 | |
| C. | 负极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 28.0L(标准状况)NO2完全处理,转移5mol电子 |
分析 A.NH3在反应中失电子,则NH3在所在的电极为负极,NO2所在的电极为正极;
B.溶液中电解质为KOH;
C.负极上氨气失电子生成氮气;
D.在标准状况下NO2是液体.
解答 解:A.NH3在反应中失电子,则NH3在所在的电极为负极,NO2所在的电极为正极,所以电极甲为电池负极,故A错误;
B.溶液中电解质为KOH,氢氧根离子向负极移动,所以应该是阴离子交换膜,故B错误;
C.负极上氨气失电子生成氮气,其电极方程式为:2NH3-6e-+6OH-═N2+6H2O,故C正确;
D.在标准状况下NO2是液体,无法计算NO2的物质的量,故D错误.
故选C.
点评 本题考查了原电池原理的应用,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握原电池中正负极的判断和电极方程式的书写.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 实验目的 |
| A | 分别取大小相近的钠粒、钾粒投入水中,观察反应的剧烈程度 | 比较钠、钾元素的金属性强弱 |
| B | 将两块相同的铝片放入不同浓度的稀盐酸中,观察产生气泡的速率 | 验证H+的浓度是影响反应速率的唯一因素 |
| C | 将少量溴水加入碘化钾溶液中,再加入CCl4,振荡,静置,观察CCl4层颜色 | 比较溴单质和碘单质的氧化性性强弱 |
| D | 向硅酸钠溶液中加入稀硫酸,观察是否有 沉淀生成 | 比较硫元素和硅元素的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33% | B. | 40% | C. | 50% | D. | 67% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L的盐酸 | B. | 0.01mol/L的醋酸溶液 | ||
| C. | c(H+)=10-3mol/L的溶液 | D. | c(OH-)=10-1mol/L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
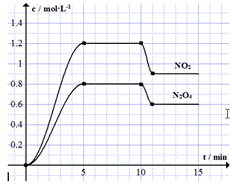 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 物质 | CaCl2 | H2O2 | AlCl3 | NH4Cl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com