
| A. | ④①②③⑤ | B. | ④③①②⑤ | C. | ⑤④③②① | D. | ②③①④⑤ |
科目:高中化学 来源: 题型:选择题
| A. | 2014年1月,国家首次将雾霾天气纳入自然灾情进行通报,雾霾是一种不同于胶体的分散系,它的形成与大量焚烧田间秸秆有关 | |
| B. | 纤维素和淀粉一样可水解成葡萄糖,因此人类可从中获得生存所需的能量 | |
| C. | 2015年诺贝尔化学奖授予从分子水平揭示细胞如何修复损伤DNA以及保护遗传信息的三位科学家,DNA水解产物为氨基酸 | |
| D. | 陶瓷刀号称贵族刀,作为现代高科技的产物,大多是用一种纳米材料“氧化锆”为原料加工而成,具有硬度高、导热性好、抗腐蚀等优点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 澄清的石灰水与稀盐酸反应 Ca (OH)2+2H+═Ca2++2H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:Na+、Fe2+、Cl-、SO42- | |
| B. | 在酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| C. | 在碱性溶液中:K+、Ba2+、SO42-、NO3- | |
| D. | 在含大量Mg2+的溶液中:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
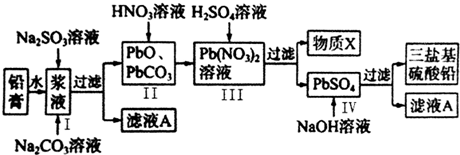
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com