
| A. | 烧碱 | B. | 纯碱 | C. | 熟石灰 | D. | 一水合氨 |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | 在①、②中分别加入氯化铵晶体,两溶液的pH值均增大 | |
| B. | 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>② | |
| C. | 把①、④两溶液等体积混合后所得溶液显酸性 | |
| D. | 将溶液②和溶液③等体积混合,混合后所得溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )
如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )| A. | x可能表示该反应的平衡常数 | |
| B. | x可能表示平衡混合物的密度 | |
| C. | 当x表示Q的体积分数时,T2<T1 | |
| D. | 当x表示平衡混合物的物质的量时,T2<T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量Cl2充分反应,转移电子数为0.2×6.02×1023 | |
| B. | 由PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O可确定氧化性:PbO2>Cl2 | |
| C. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 常温下,用蒸馏水不断稀释0.1 mol•L-1醋酸,溶液中c(H+)/c(CH3COOH)的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
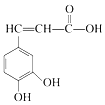
| A. | 与咖啡酸的物质类别完全相同(含咖啡酸),且苯环上只有3个取代基的同分异构体(包括顺反异构)有18种 | |
| B. | 1mol咖啡酸最多可与3molBr2反应 | |
| C. | 咖啡酸与 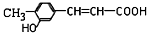 互为同系物 互为同系物 | |
| D. | 1mol咖啡酸与足量NaHCO3溶液反应产生3mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 保护钢铁水闸门可用外接电源阳极保护法 | |
| B. | 反应NH3(g)+HI(g)═NH4I(s)在低温下可自发进行,则△H>0,△S>0 | |
| C. | 常温下,向0.lmol•L-1CH3COONa溶液中滴加盐酸,溶液中水的电离程度增大 | |
| D. | 恒温下进行的反应2NO2(g)?N2O4(g)达平衡时,缩小容器体积再达平衡时,气体 的颜色比第一次平衡时的深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀为Mg(OH)2 | |
| B. | 在加入NaOH过程中生成沉淀最多为13.6g | |
| C. | 生成H2体积为5.6L | |
| D. | 刚加NaOH 溶液就有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3溶液 | B. | MgC12溶液 | C. | BaC12溶液 | D. | FeC13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com