
超临界流体(Supercritical Fluid)是温度和压力同时高于临界值的流体,也即压缩到具有接近液体密度的气体,是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在中药、香料的萃取分离以及作为溶剂、发泡剂取代氟利昂等具有重要价值。下列有关说法中错误的是
A.超临界二氧化碳与CO2的物理性质不同,化学性质相同
B.超临界二氧化碳可能是一种原子晶体
C.用超临界二氧化碳溶解萃取物质,符合绿色化学的思想
D.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第三次月考化学试卷(解析版) 题型:计算题
(共12分)
(1)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为___________________;
②溶液中由水电离出c(OH―)=______________;
③该浓度Ba(OH)2溶液与某浓度盐酸溶液按体积比1∶9混合后,所得溶液pH=11(忽略体积的变化),该盐酸溶液的pH=____________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_____________。该温度___________25℃(填“>”“=”或“<”)。
(3)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100mL,稀释后的溶液中
c(H+)/ c(OH-)=_______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
溶液、胶体、浊液三种分散系的本质区别是
A.分散质粒子直径的大小 B.是否有丁达尔效应
C.是否均一、稳定、透明 D.能否透过滤纸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z板上有H2放出,若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子,则这四种金属的活动性由强到弱的顺序为
A.X > Z > Y > M B.X > Y > Z > M
C.M > Z > X > Y D.X > Z > M > Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述Ⅰ | 表述Ⅱ | |
A | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
B | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
C | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
D | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:填空题
(10+2分)硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:

已知几种盐的溶解度随温度变化的曲线如图所示:

回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品Ⅰ的化学反应方程式为 ;实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有 。
(3)为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 ,洗涤干燥。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是

A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)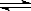 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态 (填是或否)处于平衡状态?若不是,反应向哪个方向进行?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
①①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是
C.反应②中氧化剂与还原剂的物质的量之比为6:1
D.反应③中0.1mol还原剂共失去电子数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com