
【题目】将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为________。
(2)该溶液中NaOH的质量分数为________。
(3)从该溶液中取出10 mL,溶液的密度为________,含NaOH的物质的量为________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为________。
(5)标准状况下,1.7 g NH3标准状况下________ L H2S含有相同数目的氢原子。
(6)某气体氧化物的化学式为RO2,标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
【答案】 6.1 mol·L-1 20% 1.219 g·mL-1 0.061mol 0.61 mol·L-1 3.36 64 g·moL-1 32
【解析】24.4gNaOH的物质的量为![]() =0.61mol,溶液质量为100mL×1.219g/mL=121.9g。
=0.61mol,溶液质量为100mL×1.219g/mL=121.9g。
(1)该溶液中NaOH的物质的量浓度为![]() =6.1mol/L,故答案为:6.1mol/L;
=6.1mol/L,故答案为:6.1mol/L;
(2)该溶液中NaOH的质量分数为![]() ×100%=20%,故答案为:20%;
×100%=20%,故答案为:20%;
(3)溶液是均匀的,取出10mL溶液的物质的量浓度、质量分数、密度与原溶液相等,故溶液的物质的量浓度、质量分数、密度分别为6.1mol/L、20%、1.219g/mL,该10mL溶液中氢氧化钠的物质的量为原溶液中的![]() ,为0.061mol,故答案为:1.219g/mL; 0.061mol;
,为0.061mol,故答案为:1.219g/mL; 0.061mol;
(4)取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为![]() =0.61mol/L,故答案为:0.61mol/L;
=0.61mol/L,故答案为:0.61mol/L;
(5)氨气物质的量为![]() =0.1mol,标况下氨气体积为0.1mol×22.4L/mol=2.24L,与之含有氢原子数目相等的硫化氢的物质的量为
=0.1mol,标况下氨气体积为0.1mol×22.4L/mol=2.24L,与之含有氢原子数目相等的硫化氢的物质的量为![]() =0.15mol,体积为:0.15mol×22.4L/mol =3.36L,故答案为:3.36;
=0.15mol,体积为:0.15mol×22.4L/mol =3.36L,故答案为:3.36;
(6)设该氧化物摩尔质量为M,在标准状况下,1.28g该氧化物的体积为448mL,即![]() ×22.4L/mol=0.448L,解得M=64g/mol;MR+32=64,则MR=32;故答案为:64gmol-1 ;32。
×22.4L/mol=0.448L,解得M=64g/mol;MR+32=64,则MR=32;故答案为:64gmol-1 ;32。


科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填写编号)。
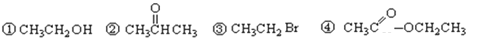

(1)芳香烃:__________;(2)卤代烃:__________;(3)醇:______________; (4)酚:______________;(5)醛:______________;(6)酮:______________;(7)羧酸:____________;(8)酯:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应离子方程式为:2Fe3+ +Fe = 3Fe2+,能实现该反应的原电池是
A. 电极材料为铁和锌,电解质溶液为Fe2(SO4)3溶液
B. 电极材料都是铁,电解质溶液为Fe(NO3)2溶液
C. 电极材料为铁和石墨,电解质溶液为FeCl3溶液
D. 电极材料为铁和石墨,电解质溶液为FeCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W是由A、B两种元素组成的AB2型化合物。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为________(填化学式)。
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为________。
②上述实验中,W与足量氯水反应的离子方程式为_____________________。
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为________。
②1 mol W与足量水充分反应,转移电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等量的镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A.2 mol·L-1H2SO4溶液
B.3 mol·L-1CuSO4溶液
C.6 mol·L-1KOH溶液
D.3 mol·L-1Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Fe和Cu混合物样品的组成,称取四份该样品分别加入相同浓度FeCl3 溶液200mL,充分反应,剩余沉淀的质量如下表:
实验序号 | I | II | Ⅲ | IV |
FeCl3溶液体积(mL) | 200 | 200 | 200 | 200 |
样品质量(g) | 9.36 | 12.48 | 15.6 | 18.72 |
沉淀质量(g) | 6.40 | 9.60 | 12.8 | 15.92 |
(1)样品中物质的量之比n(Fe)∶n(Cu) =_________。
(2)FeCl3溶液的物质的量浓度c(FeCl3)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 镁片插入硝酸银溶液中:Mg+2Ag+=== Mg2++2Ag
B. 常温下将氯气通入水中:Cl2+ H2O![]() H+ + Cl-+ HClO
H+ + Cl-+ HClO
C. 氯气与碘化钾溶液反应:Cl2+I-===2Cl-+I
D. 大理石加到盐酸中反应:CO32-+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 固体煤变为气体燃料后,燃烧效率将提高
B. 化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C. 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D. 化石燃料在任何条件下都能充分燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com