
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
分析 (1)3s时处于平衡状态,平衡时消耗的二氧化碳为0.1mol,消耗的氢气为0.05mol/(L•S)×3s×2L=0.3mol,物质的量之比等于化学计量数之比;
(2)平衡时生成甲醇为0.05mol/L×2L=0.1mol,物质的量之比等于化学计量数之比,则a:b:c=0.1:0.3:0.1=1:3:1,由元素守恒可知,D中不含碳元素,含有H、O元素,且D分子中H、O原子数目之比为(6-4):(2-1)=2:1,故D为H2O.
解答 解:(1)3s时处于平衡状态,平衡时消耗的二氧化碳为0.4mol-0.3mol=0.1mol,消耗的氢气为0.05mol/(L•S)×3s×2L=0.3mol,物质的量之比等于化学计量数之比,则a:b=0.1:0.3,故b=3a,
答:a与b的关系是b=3a;
(2)平衡时生成甲醇为0.05mol/L×2L=0.1mol,物质的量之比等于化学计量数之比,则a:b:c=0.1:0.3:0.1=1:3:1,由元素守恒可知,D中不含碳元素,含有H、O元素,且D分子中H、O原子数目之比为(6-4):(2-1)=2:1,故D为H2O,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
故答案为:1;3;1;1H2O.
点评 本题考查化学平衡计算、化学方程式配平,难度不大,(2)中注意质量守恒定律的应用,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题
 某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):
某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去): .
.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 ;
; 、
、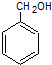 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com