
利用下列装置进行相应实验,不能达到实验目的的是
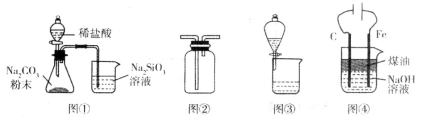
A.图①装置可验证酸性:H2CO3>H2SiO3
B.图②装置可用于收集气体H2、CO2、Cl2、NH3
C.图③装置可用于分离互不相溶的两种液体
D.图④装置可制备Fe(OH)2并能较长时间保持其颜色
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:选择题
生活处处有化学。下列说法正确的是
A.新买衣服先用水清洗以除掉残留在衣物上用作防皱整理剂的甲醛
B.冬天用纯甘油涂抹在手和面部可以防止皮肤干燥和开裂
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.保鲜膜、一次性食品袋的主要成分是聚氯乙烯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
如图所示, ,
, ,
,

下列说法或表示正确的是
A. 石墨)=
石墨)= 金刚石) △H=+1.9
金刚石) △H=+1.9
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性比金刚石弱
D. 石墨的总键能比1mol金刚石的总键能小1.9kJ
石墨的总键能比1mol金刚石的总键能小1.9kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(13分)已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,非金属性最强的元素在周期表中的位置是__________________,写出C元素的原子结构示意图____________________。
(2)B元素的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在化学键的类型为___。
(3)C元素的最高价氧化物对应的水化物与D元素的最高价氧化物反应的化学方程式为_____________。
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示转化关系。
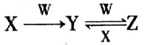
①X、Y、Z均含有同一种金属元素,若w固体俗称干冰,则反应Y→Z的离子方程式为__________;若w是强碱,且Y为白色难溶固体,则反应Z→Y的离子方程式为________________________。
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.将10 g CaCO3粉末加入100 mL水中,所得溶液的浓度为l mol·L-1
B.将100 mL 2 mol·L-1盐酸加热蒸发至50 mL,所得溶液的浓度为4 mol·L-1
C.将l0 mL l.0mol·L-1NaCl溶液与90mL水混合,所得溶液的浓度为0.1 mol·L-1
D.将10 g CaO加入100 mL饱和石灰水中,充分搅拌、静置并恢复到原来的温度,所得溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.含有食品添加剂的食物对人体健康均有害
B.普通玻璃和氮化硅陶瓷都属于新型无机非金属材料
C.大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染
D.为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.02mol?L—1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是

A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0 ×10—5mol·L—1·s—1
D.温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(15分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
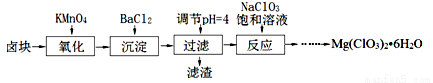
已知:
①卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
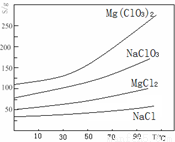
(1)“调节pH=4”可选用的试剂是 (填编号)。
①MgO ②CuO ③MgCO3 ④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是 。
(3)“滤渣”的主要成分为 。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2?6H2O的实验步骤依次为:①蒸发、浓缩、结晶;② ;③ ;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 。
(6)产品中Mg(ClO3)2?6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol?L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol?L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2?6H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:填空题
(16分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
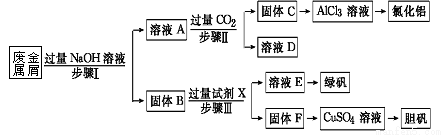
请回答:
(1)写出步骤Ⅰ反应的离子方程式: ; 。
(2)试剂X是 。由溶液D是 。
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。
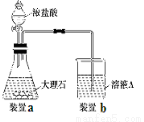
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因 。
(5)用固体F继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;写出反应的化学方程式 ,
(6)工业上常用溶液E经进一步处理可制得净水剂Na2FeO4,流程如下:
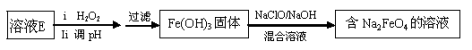
①测得溶液E中c(Fe2+) 为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25 % 的H2O2溶液___kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式____ _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com