
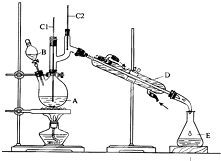
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题:
分析 本题是依据苯的性质,用苯和溴为原料制备溴苯,并对反应后的混合物进行分离与提纯,得到纯净的溴苯,实验过程中为了防止溴的挥发,需要要安装冷凝装置,冷却水通常是低进高出,反应后的混合物通常用氢氧化钠溶液洗涤后再进行分液,因溴苯的密度比水大,分层后应在下层;
(1)反应容器A是三颈烧瓶,冷却水应从下口流入,上口流出,流速较慢,可达到更好的冷凝效果;
(2)苯和液溴在铁粉作催化剂的作用下生成溴苯和溴化氢,发生取代反应;
(3)反应是利用苯和液溴发生取代反应制备溴苯,结合相关理论去判断;
(4)制备溴苯完成后,加入氢氧化钠溶液除掉过量的Br2和生成的溴化氢,混合液静置分层后,密度大的在下层.
解答 解:(1)仪器A是三颈烧瓶,冷却水应从下口流入,上口流出,流速较慢,可达到更好的冷凝效果,故答案为:三颈烧瓶;E;
(2)苯和液溴取代反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(3)A.三颈烧瓶中左边的分液漏斗中加入的是苯和液溴,错误;
B.为防止倒吸,导管不能插入锥形瓶中的液面之下,正确;
C.反应生成的HBr极易溶解于水,容易在液面上方形成大量白雾,正确;
D.利用碱石灰吸收尾气,防止有毒气体逸出,污染环境,正确;
故答案为:A;
(4)Br2是制备溴苯的反应物,制备溴苯完成后,加入氢氧化钠溶液除掉过量的Br2和生成的溴化氢,混合液静置后,因溴苯的密度比水大,分层后在下层,故答案为:反应后;除去未反应的溴和烧瓶中的HBr;溴苯.
点评 本题考查了溴苯的制备及混合物的分离与提纯,注重了基础知识考查,根据所学知识完成即可,本题难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:1 | C. | 1:5 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol | B. | 0.35mol | C. | 0.4mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠的密度比煤油大,保存在煤油中 | |
| B. | 金属钠质软,可以用小刀切割 | |
| C. | 钠的熔点比水大,钠投入到水中放热反应生成的气体中有大量水蒸气 | |
| D. | Na比Cu活泼,因而可以从Cu的盐溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.
高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.| 实验编号 | pH | 投料比(高铁酸钾与苯酚的质量比) | T/K | Fe3+ | 实验目的 |
| Ⅰ | 4 | 10:1 | 298 | 0 | 参照实验 |
| Ⅱ | 4 | 8:1 | 298 | 0 | |
| Ⅲ | 探究温度对该降解反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| B. | 向碳酸氢钡溶液中加入少许氢氧化钠:Ba2++HCO${\;}_{3}^{-}$+OH-═BaCO3↓+H2O | |
| C. | 向次氯酸钙溶液中通入过量的二氧化硫气体:SO2+H2O+ClO-═HSO${\;}_{3}^{-}$+HClO | |
| D. | 向复盐(NH4)2Fe(SO4)2溶液中加少许Ba(OH)2:SO${\;}_{4}^{2-}$+2NH${\;}_{4}^{+}$+Ba2++2OH-═BaSO4↓+2NH3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com