
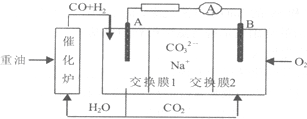
| A. | 重油是石油分馏的产品,含有的主要元素为C、H、O | |
| B. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
分析 原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,正极B上为氧气得电子生成CO32-,以此解答该题.
解答 解:A.重油是石油分馏的产品,含有的主要元素为C、H,故A错误;
B.B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故B正确;
C.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,故C错误;
D.电池工作时,阳离子向正极移动,即钠离子向电极B移动,而碳酸根离子向A极移动,故D错误.
故选B.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液与Na2S溶液混合 | B. | 将H2S气体通入Al2(SO4)3溶液中 | ||
| C. | 将Al(NO3)3固体与K2S固体混合 | D. | 将金属铝与硫混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
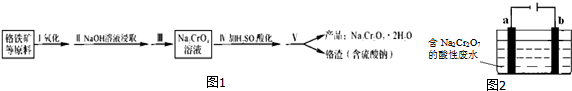
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2n | B. | 2n+2 | C. | 2n+10 | D. | n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
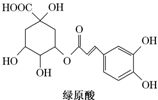 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A. | 奎尼酸分子式为C7H12O6 | |
| B. | 绿原酸能发生取代、加成、消去和缩聚反应 | |
| C. | 1mol奎尼酸与NaOH溶液反应,最多消耗5mol NaOH | |
| D. | 咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| D. | 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)═c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向苯酚溶液中逐滴加入浓溴水,生成白色沉淀: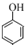 +3Br2→ +3Br2→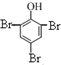 ↓+3HBr ↓+3HBr | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ | |
| C. | 向水杨酸(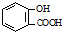 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: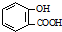 +2HCO3-→ +2HCO3-→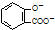 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向Ba(OH)2中加入H2SO4至中性:Ba2++OH-+SO42-+H+→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其单质在常温下跟水的反应不如钠剧烈 | |
| B. | 其原子半径比钾离子半径小 | |
| C. | In是第5周期ⅠB族元素 | |
| D. | 其氢氧化物能使氢氧化铝溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com