
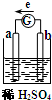
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
分析 原电池是把化学能转变为电能的装置,原电池放电时,电子从负极流向正极,所以b为负极,较活泼的金属作负极,所以负极上锌失电子发生氧化反应,a为正极,正极上氢离子得电子发生还原反应,据此分析.
解答 解:A、原电池放电时,电子从负极流向正极,所以b为负极,较活泼的金属作负极,则负极为锌,a为正极为不活泼金属铜,故A正确;
B、a为正极,正极上氢离子得电子发生还原反应,故B错误;
C、b为负极,较活泼的金属作负极,所以负极上锌失电子发生氧化反应,故C正确;
D、该装置是原电池,原电池是把化学能转变为电能的装置,故D正确;
故选B.
点评 本题考查了原电池原理,根据原电池的定义、正负极上发生的电极反应、电子的流向和电流的流向分析解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压同体积的CO2和SO2所含氧原子数均为2NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含NH4+数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | |
| B. | 若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前<N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的最简式:CHCH | B. | 甲基苯的官能团为: | ||
| C. | 丙烷分子的球棍模型示意图: | D. | -CH3(甲基)的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com