
| A. | ⑤>④>③>②>① | B. | ①>②>③>④>⑤ | C. | ④=⑤>③>①=② | D. | ①=②>③>④=⑤ |
科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
对危险化学品要在包装标签上印有警示性标志.氢氧化钠溶液应选用的标志是
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 3.36 L | C. | 4.48 L | D. | 6.72 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
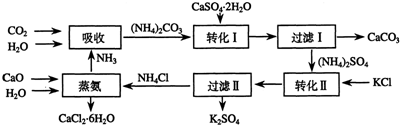
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
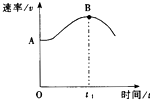
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:b | B. | a:2b | C. | a:2(a+b) | D. | a:(a+2b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.1mol | C. | 0.5mol | D. | 10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是由氢气和氧气组成的 | |
| B. | 水是由2个氢原子和1个氧原子构成的 | |
| C. | 水是由2个氢元素和1个氧元素组成的 | |
| D. | 水是由氢元素和氧元素组成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com