
【题目】金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
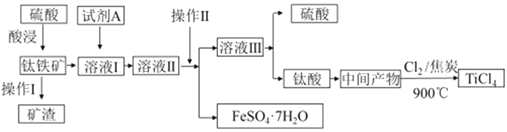
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) ![]() TiCl4(g)+O2(g) △ H=+151kJ/mol
TiCl4(g)+O2(g) △ H=+151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
方法二:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
【答案】 +2 TiOSO4+(n+1)H2O![]() TiO2·nH2O(胶体)+H2SO4 升高温度(或加热) 适当提高酸浓度(适当没有也给分)或搅拌 A 结晶 过滤 6 TiO2+2C+2Cl2
TiO2·nH2O(胶体)+H2SO4 升高温度(或加热) 适当提高酸浓度(适当没有也给分)或搅拌 A 结晶 过滤 6 TiO2+2C+2Cl2![]() TiCl4+2CO O2或氧气 CO2(或CO或CO2、CO) 方法二好,从绿色化学角度 方法一会有有毒气体氯气参与(答案合理都给分)
TiCl4+2CO O2或氧气 CO2(或CO或CO2、CO) 方法二好,从绿色化学角度 方法一会有有毒气体氯气参与(答案合理都给分)
【解析】(1)FeTiO3中钛的化合价为+4价,氧的化合价为-2价,故铁元素的化合价为+2价;加热TiOSO4溶液水解溶液呈酸性,可制备TiO2·nH2O胶体,反应的化学方程式为TiOSO4+(n+1)H2O![]() TiO2·nH2O(胶体)+H2SO4;为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有升高温度(或加热)、适当提高酸浓度、或搅拌;(2)加入A为铁粉,其目的是防止Fe2+被氧化,答案选A;溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、结晶、过滤;(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,Ksp[Fe(OH)2]=c(Fe2+)c2(OH-)=0.49mol/L×c2(OH-) =4.9×10-17,c(OH-)=
TiO2·nH2O(胶体)+H2SO4;为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有升高温度(或加热)、适当提高酸浓度、或搅拌;(2)加入A为铁粉,其目的是防止Fe2+被氧化,答案选A;溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、结晶、过滤;(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,Ksp[Fe(OH)2]=c(Fe2+)c2(OH-)=0.49mol/L×c2(OH-) =4.9×10-17,c(OH-)=![]() ,pH=6,故为防止生成Fe(OH)2沉淀,溶液的pH不超过6;(4)煅烧后产生的TiO2和氯气与焦炭均足量时生成TiCl4和CO,反应的化学方程式为TiO2+2C+2Cl2
,pH=6,故为防止生成Fe(OH)2沉淀,溶液的pH不超过6;(4)煅烧后产生的TiO2和氯气与焦炭均足量时生成TiCl4和CO,反应的化学方程式为TiO2+2C+2Cl2![]() TiCl4+2CO;(5)电解TiO2制得钛,阳极上氧离子失电子产生氧气;石墨电极可能会与氧气反应生成一氧化碳或二氧化碳;方法二好,从绿色化学角度 方法一会有有毒气体氯气参与。
TiCl4+2CO;(5)电解TiO2制得钛,阳极上氧离子失电子产生氧气;石墨电极可能会与氧气反应生成一氧化碳或二氧化碳;方法二好,从绿色化学角度 方法一会有有毒气体氯气参与。


科目:高中化学 来源: 题型:
【题目】明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)
A. 该冶炼锌的反应属于置换反应
B. 煤炭中起作用的主要成分是C
C. 冶炼Zn的反应方程式为:ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D. 倭铅是指金属锌和铅的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO![]() 、OH- B. Na+、Ca2+、CO
、OH- B. Na+、Ca2+、CO![]() 、NO
、NO![]()
C. Na+、H+、Cl-、CO![]() D. Na+、Cu2+、Cl-、SO
D. Na+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32 Cu:64等.请问这些数值准确的说法应该是( )
A.某种核素的相对原子质量
B.某种核素的近似相对原子质量
C.某种元素的平均相对原子质量
D.某种元素的平均相对原子质量的近似值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
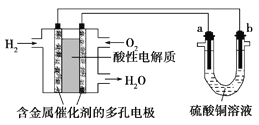
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____

(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃时,在一容积不变的容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室。左室充入氮气,右室充入氢气与氧气的混合气体,活塞恰好停留在离左端的1/4处(如下图左所示),然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间(如下图右所示),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是
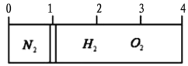

A. 3∶4 B. 4∶5 C. 6:2 D. 3∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学过程对应的方程式表示正确的是 ( )
A. 碳酸氢钠溶液的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. 碳酸钙的溶解平衡CaCO3(s) ![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. 硫化钠溶液呈碱性的原因:S2-+H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国通过蛟龙一号在东海试采可燃冰成功,可燃冰的主要成分是甲烷。下列说法不正确的是( )
A.甲烷属于烃类B.甲烷是天然气的主要成分
C.甲烷能发生取代反应D.甲烷能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com