
研究化学反应中的能量变化有重要意义。请根据学过知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:
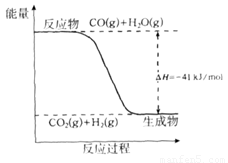
①反应的热化学方程式为____________________________________________。
②已知: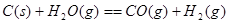
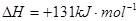
则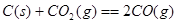
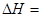
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1; N-H键的键能是391.55 kJ·mol-1。则1/2N2(g) + 3/2H2(g) == NH3(g) ΔH = 。
(1)①CO(g)+H2O(g)=CO2(g)+H2(g) △H=—41KJ/mol; ②△H=+172KJ/mol;
(2)—46.2 KJ/moL
【解析】
试题分析:(1)由能量变化图示可知该反应的热化学方程式为:①CO(g)+H2O(g)=CO2(g)+H2(g) △H=—41KJ/mol;②将CO(g)+H2O(g)=CO2(g)+H2(g)减去C(s)+H2O(g)=CO(g)+H2(g),整理可得:C(s)+CO2(g)-2CO(g) △H=+172KJ/mol;(2)根据键能的定义及与反应热的关系可知: △H=1/2×948.9kJ/mol+3/2×436.0 kJ/mol-3×391.55kJ/mol=—46.2 KJ/moL
考点:考查热化学方程式的书写、盖斯定律的应用级反应热与化学键的键能的关系的知识。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:

在一个小烧杯里加入约
试完成下列问题:
(1)写出反应的化学方程式:____________________________________________。
(2)实验中要立即用玻璃棒迅速搅拌的原因是______________________________________。
(3)如果实验中没看到“结冰”现象,可能的原因是__________________________________
____________________________________________________________________。(答出三个或三个以上原因)。
(4)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
______________________________________________________________(答出两种方案)。
(5)实验中即使不“结冰”,提起烧杯的时候,发现烧杯与玻璃片也“粘在一起了”,原因是____________________________________________________________________。
(6)试用简单的方法说明烧杯与玻璃片之间是因为“结冰”而粘在一起的:_________________
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省安阳一中高一下学期第二次阶段测试化学试卷(带解析) 题型:填空题
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘单质反应(H2+I2=2HI)生成1 mol HI需要 (填“放出”或“吸收”) ___ kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
在如图甲装置中,负极电极反应式为 ,发生的是 反应(填“氧化”或“还原”,下同)。正极电极反应式为 ;总反应的离子方程式为 。
(3)若用氢氧化钾溶液做电解质溶液,用氢气做燃料,空气做氧化剂制成燃料电池,其负极反应式为 ;正极反应式为 。当有标状下2.24L氢气消耗时,另一极消耗氧气的物质的量为 。
(4)在如下图所示的原电池中,铝做 极,导线上电子由 极流向 极。
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏南通小海中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
如图甲是将 能转化为 能的装置,负极电极反应式为 ,发生______反应(填“氧化”或“还原”,下同)。正极现象 ,发生______反应;发生反应时,电子由_____片流向_____片。当导线中有2 mol电子通过时,正极上析出 g 氢气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com