
【题目】Ⅰ、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) ![]() CH3OH(g)
CH3OH(g)
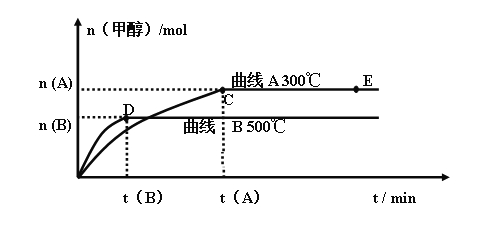
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值____________(填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是___________
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃) | 700 | 800 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.7 | 2.6 |
(1) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.053 mol,若将混合气体加热至830℃,平衡时CO2的物质的量_____ (填“大于”、等于“”或“小于”)0.053 mol。
(2)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
【答案】减小 b c 小于 逆反应
【解析】
Ⅰ、由图象可知达到平衡后,升高温度,甲醇的物质的量减小,平衡向左移动,正反应为放热反应,因为升高温度平衡向吸热方向移动;
Ⅱ、根据表中的数据可知,温度越高,化学平衡常数越大,所以该反应为吸热反应。
Ⅰ.(1)该反应正反应为放热反应,升高温度平衡向吸热方向移动,K减小,故答案为:减小;
(2)增大压强,压缩体积,正、逆反应速率都增大,平衡向右移动,甲醇的物质的量增大,氢气的物质的量减小,但是体积缩小,氢气的浓度增大,b、c正确,故答案为:bc;
Ⅱ、(1)升高温度平衡向正反应移动,则将混合气体加热至830℃,平衡时反应物CO2的物质的量小于0.053 mol,故答案为:小于;
(2)800℃时,放入CO、H2O、CO2、H2的物质的量分别为:0.01 mol、0.01 mol、0.01 mol、0.01mol,则在1 L的密闭容器中浓度熵Q= c(CO2)c(H2)/c(CO)c(H2O)=(0.01 mol/L×0.01 mol/L)/ (0.01 mol/L×0.01 mol/L)=1>0.9,平衡向逆反应方向移动,故答案为:逆反应。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置能达到所述的实验目的的是

A.利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩
B.利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成
C.利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成
D.利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物分子的空间结构为正四面体,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为23︰16,有两种含Y元素的可溶性化合物E和F,在10mL1.0mol·L-1E溶液中滴加1.0mol·L-1F溶液,产生沉淀的物质的量(n)与F溶液体积(V)的关系如图所示。下列说法一定正确的是

A. 原子半径:X>Y>R
B. 最高价氧化物对应水化物的酸性:Z>Y>R
C. X和Y的单质组成的混合物不能完全溶于水
D. 工业上,通过电解熔融氯化物制备Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D. P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )
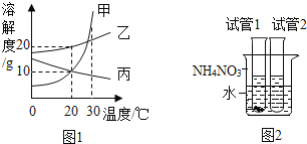
A. 甲物质的溶解度比乙物质的溶解度大
B. 加入试管1的固体是丙
C. 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应2A![]() B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
A. 正反应是吸热反应,且A不是气态
B. 正反应是放热反应,且A是气态
C. 其他条件不变,加入少量A,该平衡向正反应方向移动
D. 改变压强对该平衡的移动无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com