
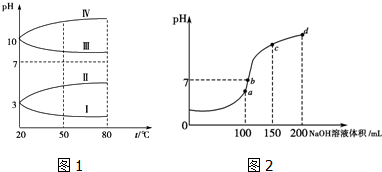
分析 (1)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故答案为:小于;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;NH4Al(SO4)2水解使溶液呈酸性,升高温度,其水解程度增大,pH减小;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1[c(OH-)太小,可忽略],故答案为:10-3 mol•L-1;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查盐类的水解和离子浓度大小的比较,题目难度较大,(3)②为易错点,注意根据守恒思想解题.


科目:高中化学 来源: 题型:选择题
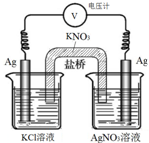 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag+(aq)+Cl-(aq)?AgCl(s) | D. | 盐桥中的K+向右池方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 错误 | 原因分析及改正 | |
| A | FeBr2溶液中通入少量Cl2的离子方程式: 2Br-+Cl2═Br2+2Cl- | 还原性强弱:Fe2+>Br-; 改正:2Fe2++Cl2=2Fe3++2Cl-. |
| B | 除去CO2中的HCl气体:通过饱合Na2CO3溶液,分离方法:洗气 | “饱合”应为“饱和”,Na2CO3不仅要吸收HCl气体,还要吸收CO2,应改用饱和NaHCO3溶液;分离方法:洗气. |
| C | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液.指示剂:甲基橙,终点判断:当滴至最后一滴标准液,溶液由黄色变为橙色,即达终点. | 指示剂不能用甲基橙,改用酚酞,终点判断:当滴至最后一滴标准液,溶液由红色变为浅红色,即达终点. |
| D | 双原子分子一定是非极性分子 | 双原子分子有可能为单质或化合物分子; 改正:双原子单质分子一定是非极性分子而双原子化合物分子一定是极性分子. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液、氯水 | B. | 稀盐酸、KMnO4溶液 | ||
| C. | 稀硫酸、KMnO4溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠跟冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com