
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫酸反应,转移电子数目为0.2NA
D.常温下,1 L 1 molL﹣1的CH3COOH溶液中,所含溶质分子数小于NA
【答案】D
【解析】A.标准状况下,22.4L一氧化氮的物质的量为1mol,11.2L氧气的物质的量为0.5mol,二者恰好反应生成1mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,则反应后的物质分子小于1mol,得到的气体分子数小于NA,A不符合题意;
B.3.6g重水的物质的量为: ![]() =0.18mol,0.18mol重水中含有1.8mol中子,含有的中子数为1.8NA,B不符合题意;
=0.18mol,0.18mol重水中含有1.8mol中子,含有的中子数为1.8NA,B不符合题意;
C.6.4g铜的物质的量为: ![]() =0.1mol,0.1mol铜与S单质完全反应转移0.1mol电子,转移电子数目为0.1NA,C不符合题意;
=0.1mol,0.1mol铜与S单质完全反应转移0.1mol电子,转移电子数目为0.1NA,C不符合题意;
D.1L 1molL﹣1的CH3COOH溶液中含有溶质醋酸的物质的量为1mol,由于醋酸部分电离,则溶液中醋酸分子小于1mol,所含溶质分子数小于NA,D符合题意;
所以答案是:D


科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO![]() 、NO
、NO![]() 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
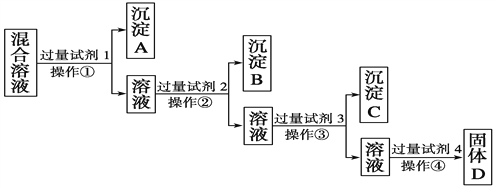
(1)写出上述实验过程中所用试剂的名称:试剂1为______________,试剂2为______________。
(2)控制试剂4的加入量的方法是__________________________。
(3)加入过量试剂3的目的是__________________________________。
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是______________________(填操作名称)。
(5)写出加入试剂4后发生反应的化学方程式:
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是
A.风力发电,让能源更清洁B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康D.环保涂料,让环境更宜居
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(OH)2、CuSO4、HCl可以归为一类,下列物质可以和它们归为一类( )
A. 75%的酒精溶液 B. 硝酸钠 C. Fe(OH)3胶体 D. 豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气。根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:

操作步骤及有关现象如下:
①装好装置,检查装置的气密性,加入药品。
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)用化学方程式表示实验室制取Cl2的反应:____________________________________;若以含14.6g HCl的浓盐酸与足量MnO2充分反应,制得的Cl2在标准状况下总小于2.24L,原因可能是____________________________________________________。
(2)装置B中为湿润的KI-淀粉试纸,反应一段时间后试纸变蓝,能否仅通过该现象说明A装置中产生氯气?___________(填“能”或“不能”),请用离子方程式说明原因________;装置C中湿润的红色布条褪色,是因为产生了具有强氧化性的物质:_____。
(3)实验证明,Na2O2可以与HCl反应生成氯气,请写出反应的化学方程式:_____________。
(4)装置D的作用之一是吸收生成的氯气,请写出相应的离子方程式:_________________。
(5)利用Na2O2与浓盐酸反应制得的Cl2中通常含有的杂质气体有:___________(不包括水蒸气),较难分离,因此实验室很少用该方法制取氯气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上SnSO4的制备路线如图:
已知:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.
回答下列问题:
(1)锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是 .
(2)操作Ⅰ是、、过滤、洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因: .
(4)加入锡粉的作用有两个:①调节溶液pH,② .
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,反应为Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3氧化Sn2+生成Sn4+;
③用已知浓度的盐酸酸化过的K2Cr2O7滴定生成的FeCl2 , 反应的化学方程是:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
取1.360g锡粉,经上述各步反应后,共用去0.100molL﹣1K2Cr2O7溶液33.00mL,则锡粉中锡的质量分数是 . (保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图) 
据此回答下列问题:
(1)常温下含碳量最高的气态烃是(填对应字母).
(2)能够发生加成反应的烃有(填数字)种.
(3)一卤代物种类最多的是(填对应字母) .
(4)写出实验室制取C的化学方程式 .
(5)写出F发生溴代反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com