
分析 利用盖斯定律及已知热化学方程式写出目标反应的热化学方程式;物质的能量越低,越稳定,据此判断白磷和红磷的稳定性.
解答 解:P4(白磷,s)+5O2(g)=P4O10(s)△H=-2983.2kJ•mol-1 ①
P(红磷,s)+5/4O2(g)=1/4P4O10(s)△H=-738.5kJ•mol-1 ②
据盖斯定律,①-②×4可得:P4(白磷,s)═4P(红磷,s)△H=-29.2kJ•mol-1,
从上面的热化学方程式可知,白磷转化为红磷是放热反应,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定,
故答案为:P4(白磷,s)═4P(红磷,s)△H=-29.2kJ•mol-1;红磷;低.
点评 本题考查了盖斯定律在热化学方程式计算中的应用,题目难度中等,注意掌握热化学方程式的书写原则,明确盖斯定律的含义及在热化学方程式计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 4.48L | C. | 5.56L | D. | 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若pH>7,则一定是C1V1=C2V2 | |
| B. | 在任何情况下都是c(Na+)+c(H+)=C(CH3COO-)+c(OH-) | |
| C. | 当pH=7时,若V1=V2,则一定是C1>C2 | |
| D. | 若V1=V2,C1=C2Z,则 C(CH3COO-)+C(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 氯化铵与氢氧化钠两种浓溶液混合加热 NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| C. | 氢氧化镁与稀硫酸反应 H++OH-═H2O | |
| D. | 单质铜与稀硝酸反应 Cu+2H++2NO3-═Cu2++2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸易挥发,盛在无色密封的玻璃瓶中 | |
| B. | 氟化氢有剧毒,保存在有塑料盖的玻璃瓶中 | |
| C. | 液溴易挥发,盛放在用水封的棕色瓶中 | |
| D. | 碘易升华,保存在棕色瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团). .
. +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.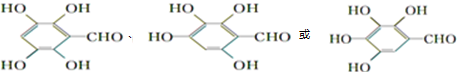 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com